すべての変異型を逃さない新型コロナウイルス感染症治療薬候補の開発―薬剤耐性株が生じない創薬に期待―
プレスリリース
京都府立医科大学
大阪大学
日本医療研究開発機構
京都府立医科大学大学院医学研究科循環器内科学 星野温 助教、大阪大学蛋白質研究所 高木淳一 教授、高等共創研究院 岡本徹 教授(微生物病研究所兼任)らの研究グループは新型コロナウイルスが感染する際の受容体であるACE2タンパク質を改変してウイルスとの結合力を約100倍にまで高め、抗体製剤と同等の治療効果を持つウイルス中和タンパク質(改変ACE2受容体)を開発しました。この改変ACE2受容体は抗体製剤等を用いた治療で懸念されるウイルス変異株による治療効果の減弱が起こらない大きな利点があります。今年に入り感染拡大の原因となったイギリス株(N501Y変異)や免疫逃避型系統株(E484K変異)に対しても有効で、直近の検討では今後広がりが懸念されるインド株(L452R変異)に対しても効果が確認できました。またウイルスが変異により改変ACE2受容体から逃避した場合、その変異ウイルスは細胞表面のACE2タンパク質にも結合できず細胞侵入を果たせなくなります。そのため将来にわたり本受容体に対する逃避変異株が生じる心配がなく、新型コロナウイルス感染症が克服されるまで使い続けることができると期待されます。本研究成果は2021年6月21日(月)に英国科学雑誌Nature Communications誌に掲載されました。
研究成果のポイント
- 新型コロナウイルスの感染受容体であるACE2タンパク質を指向性進化法(注1)と呼ばれるタンパク質工学的手法により改変し、ウイルスとの親和性を約100倍高めることに成功しました。
- この高親和性ACE2を用いた中和タンパク質(改変ACE2受容体)はハムスターの新型コロナウイルス感染症(COVID-19)モデルにおいて高い治療効果を示しました。
- 中和抗体などの抗体製剤は薬剤耐性をきたす逃避変異(注2)が問題となりますが、本改変ACE2受容体は、新型コロナウイルスの感染受容体であるACE2タンパク質を用いているため、逃避変異株の出現は観察されず、感染症を克服するまで使い続けることができます。
- 改変ACE2受容体は、これまでに問題となってきた感染力が強いN501Y変異や免疫逃避型E484Kを持つ変異株に対しても良好な中和活性を示します。
本研究の背景
新型コロナウイルス感染症(COVID-19)は2019年末に出現してから、変異株の出現を伴って世界中で猛威を振るってきました。これまでにCOVID-19治療薬として新規に創製され開発され使用されているものは中和抗体製剤のみですが、抗体製剤ではウイルスが変異によって薬剤から逃れる逃避変異が問題となります。実際に、これまでに開発された抗体製剤のいくつかは効果が消失する変異株が存在するため、複数の抗体を混ぜてカクテル製剤として用いる対応が取られています。そのため、COVID-19のような新興のウイルス感染症では、迅速に開発ができ、逃避変異が生じずに一度開発すれば感染症を克服するまで使用が可能な治療薬が求められています。
本研究の内容
指向性進化法による高親和性ACE2の開発
迅速に開発ができ逃避変異が生じない治療薬として、新型コロナウイルス感染受容体であるACE2に着目して開発に取り組みました。今回採用した、受容体の細胞外領域をヒト免疫グロブリンIgG1の重鎖定常領域(Fc領域(注3))と繋げた融合タンパク製剤は、既に関節リウマチ等の治療薬として実用化されています。しかし、ACE2の場合は新型コロナウイルスとの結合力がそれほど強くなく、通常のタンパク製剤の血中濃度では有効な中和活性を示しませんでした。そこで、指向性進化法と呼ばれるタンパク質工学的手法を用いて、ウイルスとの結合力を高めることに取り組みました。まず、増幅エラーが入りやすい核酸増幅法でACE2遺伝子にランダム変異を導入し、約10万種類のACE2変異体ライブラリを作製しました。このライブラリを発現した細胞に新型コロナウイルスのスパイク(S)タンパク質を反応させて、強く結合したACE2変異体発現細胞を回収し、高親和性ACE2変異体の遺伝子を抽出しました。その後、この変異体遺伝子に再度10万種類のランダム変異を追加したライブラリを作製し、そこからさらに高親和性の変異体遺伝子を抽出しました。今回はこのサイクルを3回繰り返すことで、野生型ACE2タンパク質よりウイルスとの結合力が約100倍亢進した高親和性ACE2を3種類取得することに成功しました(図1)。
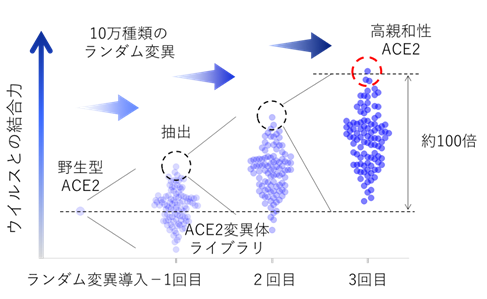
高親和性ACE2の結合力とウイルス中和活性
高親和性ACE2と新型コロナウイルスのスパイク(S)タンパク質の結合力を、表面プラズモン共鳴法により測定したところ、野生型ACE2の解離定数が17.63nMであるのに対して、3種類の高親和性ACE2は0.29~3.98nM(結合力が高いほど低い値になる)と最大で100倍近い結合力の向上を認めました。また、ACE2をヒトの免疫グロブリンIgG1のFc領域と結合させた改変ACE2受容体で疑似ウイルス(注4)に対する中和活性を評価したところ、50%感染阻害濃度(IC50)が野生型では24.8μg/mlであるのに対して、各種改変ACE2は0.056~0.33μg/mlと最大で100分の1以下の濃度となりました。また2002年に流行し、同じくACE2を受容体として感染するSARSコロナウイルスの疑似ウイルスに対しても同様に評価したところ、2つの変異体でIC50が0.022~0.027μg/mlと高い中和活性が維持され、幅広いウイルス変異株に中和活性が維持されることが示唆されました。
新型コロナウイルス感染症(COVID-19)ハムスターモデルにおける治療効果
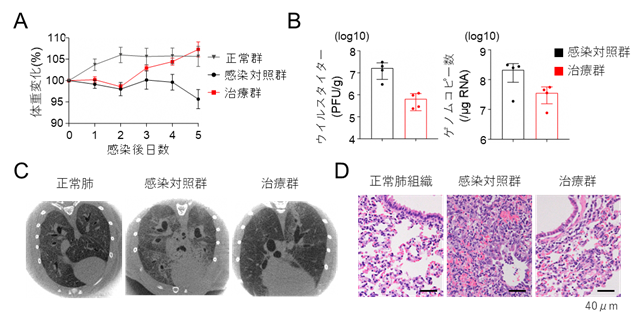
COVID-19モデル動物実験はハムスターを用いて行いました。鼻粘膜にウイルスを感染させた後に改変ACE2受容体を投与し、体重変化と肺炎所見を評価しました。ウイルス感染により対照群では体重が4.3%低下しましたが、改変ACE2受容体投与治療群では7.3%増加し、非ウイルス投与群(非感染対照群)と同等まで回復しました(図2A)。また肺組織のウイルス量も10分の1程度まで抑制され(図2B)、CT画像でもウイルス投与により広範囲にすりガラス陰影が出現するのに対し、治療群では陰影が顕著に減少していました(図2C)。また、肺病理組織では治療群で肺胞出血や炎症細胞浸潤が少なく、肺炎の重症化も抑制されました。
逃避変異抵抗性と変異株への有効性
新型コロナウイルスの感染受容体ACE2に基づく改変ACE2受容体では、ウイルスが変異により改変ACE2受容体に結合しなくなった場合、細胞表面のACE2とも結合できずに感染力を失うことになります。そのため実質的に逃避変異が生じないと考えられます。この仮説を、ウイルスに対する耐性株が出現しやすくなる評価系(改変ACE2受容体を部分的有効濃度にして新型コロナウイルスの培養を繰り返す)を用いて確認しました。コントロールとして用いたモノクローナル抗体(中和抗体)では、4継代目で完全に耐性株に置換されましたが、改変ACE2受容体では15継代を経ても耐性株は出現せず、実際に逃避変異が出現しないことが確認できました。
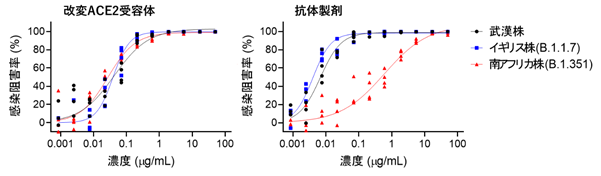
また現在脅威となっているウイルス変異株に関しては、感染力が強いN501Y変異をもつイギリス株(WHO分類:α株)に対しても有効で、ワクチンや一部のモノクローナル抗体が効きにくい免疫逃避型E484K変異をもつ南アフリカ株(WHO分類:β株)に対しては、現在米国で使用が許可されているリジェネロン社のREGN10933抗体は中和活性の大きな低下を認めましたが、改変ACE2受容体では中和活性が良好に維持されていました(図3)。
まとめと今後の展開
新型コロナウイルスの受容体であるACE2タンパク質のウイルス親和性を高めることで、抗体製剤と同等の中和活性を有し、かつ逃避変異に抵抗性である高親和性ACE2変異体の作出が可能であることが証明されました。また、ACE2を利用した中和タンパク質(受容体)において、COVID-19モデル動物実験で治療効果を証明したのは本研究が最初になります。さらに今回のACE2変異体では、ウイルスのスパイク(S)タンパク質との複合体の立体構造の決定にも成功し、高親和性獲得のメカニズムが明らかにできただけでなく、体内寿命が長い安定なタンパク質製剤をデザインするヒントも得られました。今回の指向性進化法による高親和性ACE2変異体の作出は1か月程度で可能で、また抗体製剤とは異なり患者検体を必要としない利点もあります。今回のCOVID-19だけでなく将来の新たなウイルスパンデミックにおいても、薬剤耐性株出現の懸念なく迅速な治療薬開発が可能な新規モダリティとして期待されます。
この改変ACE2受容体は今後拡大が懸念されるインド株にも有効であることを確認し、現在製薬企業と共同で前臨床試験に取り組んでいます。
用語解説
- (注1)指向性進化法
- 自然界の進化に倣ってDNAの突然変異誘発による多様化と選択のサイクルを繰り返すことで、自然界にはみられない高性能なタンパクを作出する技術で、本手法は金属酵素の開発に大きく貢献したとして、2018年にフランシス・アーノルドがノーベル化学賞を受賞しました。
- (注2)逃避変異
- ウイルスが遺伝子を変異させることで抗体や化合物の標的部位の形状を変化させ、結合できなくする事で薬剤耐性を獲得する変異。
- (注3)Fc領域
- 抗体の"Y"字の下半分の縦棒部分にあたる部分で、免疫細胞や補体と結合することで抗体が抗原と結合した後の免疫反応を媒介します。
- (注4)疑似ウイルス
- レトロウイルスの粒子表面のエンベロープタンパク質を別のウイルス由来のものに置き換えたウイルスで、今回はエンベロープタンパク質の代わりに新型コロナウイルスのスパイク(S)タンパク質を外套させています。危険性の高い新型コロナウイルスの代わりに疑似ウイルスを用いる事で比較的安全に実験が行えます。
掲載論文・雑誌
- タイトル
- Engineered ACE2 receptor therapy overcomes mutational escape of SARS-CoV-2
「改変ACE2受容体は新型コロナウイルスの逃避変異を克服する」 - 著者
- Yusuke Higuchi1, Tatsuya Suzuki, Takao Arimori, Nariko Ikemura, Emiko Mihara, Yuhei Kirita, Eriko Ohgitani, Osam Mazda, Daisuke Motooka, Shota Nakamura, Yusuke Sakai, Yumi Itoh, Fuminori Sugihara, Yoshiharu Matsuura, Satoaki Matoba, Toru Okamoto*, Junichi Takagi*, Atsushi Hoshino*
責任著者:星野温、高木淳一、岡本徹 - 雑誌名
- Nature Communications 2021年6月21日(日本時間18時00分)オンライン掲載
- DOI
- 10.1038/s41467-021-24013-y
特記事項
本研究は、日本医療研究開発機構(AMED)新興・再興感染症に対する革新的医薬品等開発推進研究事業、創薬等ライフサイエンス研究支援基盤事業(BINDS)、そして先進医薬研究振興財団の研究支援を受けて実施されました。
お問い合わせ先
研究に関すること
京都府立医科大学 大学院医学研究科 循環器内科学
助教 星野 温
TEL:075-251-5511
E-mail:a-hoshi“AT”koto.kpu-m.ac.jp
大阪大学 蛋白質研究所 分子創製学研究室
教授 高木 淳一
TEL:06-6879-8607
E-mail:takagi“AT”protein.osaka-u.ac.jp
大阪大学 微生物病研究所 高等共創研究院
教授 岡本 徹
TEL:06-6879-8330
E-mail:toru“AT”biken.osaka-u.ac.jp
報道に関すること
京都府立医科大学 企画広報課
担当 土屋
TEL:075-251-5804
E-mail:kouhou“AT”koto.kpu-m.ac.jp
大阪大学 蛋白質研究所 広報室
TEL:06-6879-4317
E-mail:kouhou“AT”protein.osaka-u.ac.jp
大阪大学 微生物病研究所 企画広報推進室
TEL:06-6879-8357
E-mail:biken-pr“AT”biken.osaka-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
新興・再興感染症に対する革新的医薬品等開発推進研究事業
創薬事業部 創薬企画・評価課
TEL:03-6870-2226
E-mail:shinkou-saikou“AT”amed.go.jp
創薬等ライフサイエンス研究支援基盤事業(BINDS)
創薬事業部 医薬品研究開発課
TEL:03-6870-2219
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年6月21日
最終更新日 令和3年6月21日


