プレスリリース 肝臓由来の細胞外小胞の抗炎症機能を発見―急性肝障害の治療法に新たな道―
プレスリリース
東海大学
科学技術振興機構(JST)
日本医療研究開発機構(AMED)
ポイント
- 急性肝障害への治療は肝移植や間葉系幹細胞(MSC)を用いた再生療法など、治療が限定されていた
- ヒト肝細胞由来の細胞外小胞は急性肝障害に対して組織保護的に働くことを明らかにした
- 簡便で増殖の早い細胞を用いることで、肝移植などに限定されていた急性肝障害の新たな治療法を提示することができる
概要
JST戦略的創造研究推進事業、AMED肝炎等克服実用化研究事業および次世代がん医療創生研究事業において、東海大学の幸谷愛(コウタニ アイ)教授は、柿崎正敏特任助教(当時)、山本雄一朗大学院生(当時)、中山駿矢研究員らとともに、ヒト幹細胞由来の細胞外小胞が急性肝障害に対して組織保護的に働くことを発見しました。
従来、急性肝障害に対しては肝臓移植の他、近年では間葉系幹細胞(Mesenchymal Stem Cell:MSC)(注1)などを用いた新規治療法などの研究が進んでいましたが、問題点も多く、より簡便な急性肝障害に対する治療法の開発が望まれていました。
本研究グループは、ヒト肝細胞由来の細胞外小胞(extracellular vesicles:EVs)(注2)が分化多様性を持つ間葉系幹細胞のEVsと同等か、それ以上に急性肝障害に対して骨髄からの好中球(注3)の誘導を抑えるなど、保護的に働き、炎症を制御し得ることを明らかにしました。
さまざまな免疫調整効果を持つヒト肝細胞由来の細胞外小胞は急性肝障害に対する新たな治療法としてだけでなく、多様な肝臓の疾患に対する治療法への波及が期待されます。
本研究成果は、自治医科大学の亀田和明特別研究員、千葉大学の千葉哲博講師らをはじめとする複数機関との共同研究によって得られ、研究成果は、2021年10月26日午前1時(英国時間)に英国科学誌「Cell Death and Disease」のオンライン版で公開されました。
研究支援について
本成果は、以下の事業・研究領域・研究課題によって得られました。
- JST戦略的創造研究推進事業 チーム型研究(CREST)
- 研究領域:「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」
(研究総括:馬場嘉信名古屋大学 大学院工学研究科 教授) - 研究課題名:「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」
- 研究代表者:渡邉力也(理化学研究所 主任研究員)
- 研究期間:平成29年10月~令和6年3月
- JSTはこの領域で、細胞外微粒子に起因する生命現象の解明及びその理解に基づく制御技術の導出を目的とします。上記研究課題では、理・工・医学の融合により生体微粒子の組成・機能を解析し、疾患の制御に向けた新規医薬技術基盤の創出を目指します。
- AMED肝炎等克服実用化研究事業
- 研究課題名:「B型肝炎ウイルスRNAと相互作用する宿主因子の網羅的同定とその制御による病態制御法開発」
- 研究代表者:大塚基之(東京大学医学部附属病院 講師)
- 研究期間:令和元年~令和3年
- AMED次世代がん医療創生研究事業
- 研究課題名:「劇症型NK白血病における独特なニッチの分子基盤解明とその制御法開発」
- 研究代表者:幸谷愛(東海大学医学部 教授)
- 研究期間:令和2年~令和3年
- 研究課題名:「細胞外脂質代謝酵素によるエクソソームの脂質修飾を介したがん微小環境の制御」
- 研究代表者:村上誠(東京大学医学部 教授)
- 研究期間:令和2年~令和3年
研究の背景と経緯
肝臓は糖質やタンパク質、脂質の代謝のほか、血液中に含まれる薬物の代謝や腸管から取り込まれたさまざまな抗原に対する免疫の前線として機能しています。一方で外部からの刺激を受けやすいため炎症が誘発され、急性肝障害を引き起こします。肝障害が悪化することにより急性肝不全を発症し、場合によっては肝移植を必要とするような病態も引き起こされます。移植には多くの問題が存在するため、移植に代わる新たな治療法が期待されてきました。
近年、間葉系幹細胞(MSC)が肝臓の炎症や線維化を抑制することが報告され、さらにその抗炎症作用が細胞から分泌される細胞外小胞(EVs)によって媒介されていることが発見され、注目されています。また、肝細胞が分泌するEVsもこうした抗炎症作用を持つ可能性を示唆する報告がなされています。そこで、本研究では肝細胞由来細胞株としてヒト肝臓がん由来細胞株(HepG2)およびヒト初代肝細胞株(PXB)を用い、四塩化炭素(CCL4)誘発急性肝障害モデルマウスにおいてこれらのEVsが抗炎症効果を示すのか、またその抗炎症メカニズムの一端をEVs表面のω3系多価不飽和脂肪酸(PUFA)(注4)をはじめとする脂肪酸が担っているのではないかという仮説のもと、検証を行いました。
研究の内容
まず、肝細胞由来EVs(ヒト肝臓がん由来細胞株(HepG2)由来EVs:G2EVs、およびヒト初代肝細胞株(PXB)由来EVs:PXBEVs)が、抗炎症作用を有すると以前より報告されているMSC由来EVs(MSCEVs)と比較してどの程度の効果を示すかについて、EVsを投与したCCL4誘発急性肝障害モデルマウスで検討しました。その結果、肝細胞由来EVsはMSCEVsに比べて同等か場合によってはそれ以上の抗炎症作用を示すことがわかりました(図1)。また、CCL4によって事前に肝障害を発症させたマウスに対して肝細胞由来EVsを投与したところ、肝障害を示す血清中の酵素(GOT・GPT)(注5、6)の値が有意に抑制されたことから、肝細胞由来のEVsはCCL4誘発急性肝障害に対して治療的な効果も持つことがわかりました。
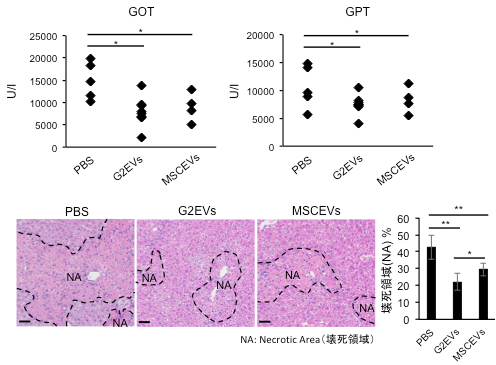
次に本研究チームはこのCCL4誘発急性肝障害に対するEVsの保護メカニズムを明らかにするために肝臓に存在する単球系細胞(注7)であるクッパー細胞(KCs)(注8)の炎症性サイトカイン(注9)発現量をRT-PCR(注10)を用いて解析しました。
通常CCL4誘発急性肝障害では肝臓に存在する単核球系細胞であるクッパー細胞を中心とした炎症が発生します。肝障害の肝臓中ではさまざまなサイトカインやケモカインなどが分泌され、さらなる白血球の誘導が引き起こされます。本研究では肝細胞由来のEVsを投与したマウスに急性肝障害を誘発したところ、これらの炎症性サイトカインの発現はいずれも減少し、また好中球誘導性のケモカインであるCXCL1、CXCL2の発現も強く抑制されました(図2)。
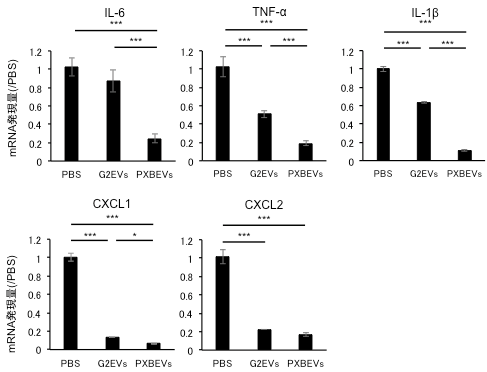
これらのことから肝細胞由来のEVsは肝臓のKCsに働き、炎症性サイトカインを抑制するほか、単球や好中球の遊走を抑制することでさらなる炎症の波及を抑制する効果を示すことが明らかになりました。
実際、これらの肝細胞由来EVsを投与したマウスの肝臓では好中球表面マーカーであるGr-1に陽性を示す好中球および単球系マーカーであるF4/80に陽性を示すマクロファージが有意に減少していました。また、好中球が産生する活性酸素種(ROS)も減少していたことから、好中球およびマクロファージの遊走が抑制され、これらの細胞が産生するROSが減少することで炎症を制御していることが明らかとなりました(図3)。
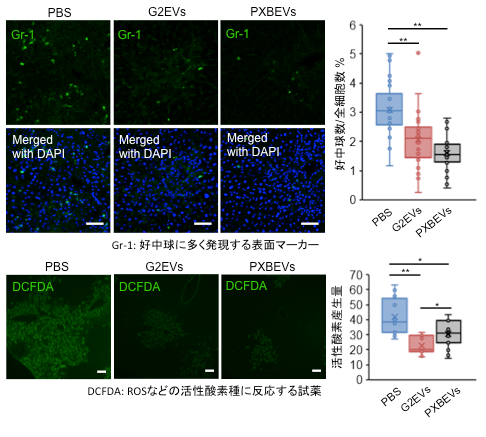
本研究グループは、以前の研究でB型肝炎ウイルス(HBV)に感染したHepG2のEVsが肝臓のKCsだけではなく骨髄単球(BMMC)に取り込まれることを明らかにしています。この研究ではHBVに感染した細胞が分泌するEVsはBMMCに取り込まれ、ウイルスの肝臓における増殖を助けることが明らかにされました。
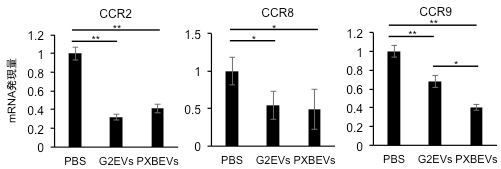
今回はHBV感染細胞EVsと同様に肝細胞由来EVsが肝臓の免疫調整機能に関与するかを確認したところ、HBV感染細胞EVsと同じくBMMCを介して過剰な免疫誘導を抑制していることが明らかとなりました。
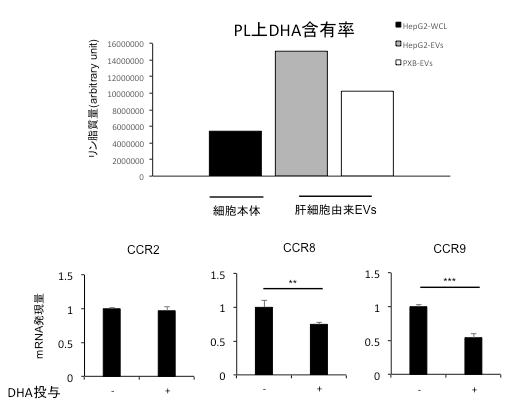
続いて、これらの抗炎症作用がEVsの何に由来するのかを解析するため、EVsの表面を覆うリン脂質(Phospho-Lipid:PL)に着目し検討を行いました。PLには炎症に関与するといわれているアラキドン酸(AA)などの6価の多価不飽和脂肪酸(PUFA)や抗炎症に関与することが報告されているドコサヘキサエン酸(DHA)やエイコサペンタエン酸(EPA)などの3価のPUFAが存在します。今回、G2EVsおよびPXBEVsについてPLに含まれるPUFAの量を定量解析したところ、特にG2EVsにおいて細胞本体に比べて多くのDHA結合PLを含有していたことからEVsに含まれるDHAが急性肝障害の治療効果に関与することが考えられました。また、マウスの骨髄細胞にDHAを添加したところ、炎症に関与する受容体が抑制されていたことから、肝細胞由来EVsの抗炎症作用の一端にDHAをはじめとする3価PUFAの関与が裏付けられました。
今後の展開
これらの結果により、急性肝障害および急性肝不全に対して肝細胞由来のEVsが、以前から肝細胞保護効果を示すことが知られているMSC由来EVsと同等に抗炎症作用、肝臓保護作用を示すことを明らかにしました。また、DHAを豊富に含むEVsが肝臓および骨髄へと作用し抗炎症作用を示すことから、肝細胞由来EVsの炎症制御機構解明は急性肝障害および急性肝不全に対する治療法開発の新たなアプローチを示唆するものです。
今後はこれらの結果をもとに、よりヒトに近い免疫系を持つヒト化マウスを用いた急性肝障害モデルによるヒト免疫系に対する肝細胞由来EVsの作用や、ヒトの肝臓をもつヒト肝細胞キメラマウスなど、ヒトの組織を持つマウスを用いてさらなる研究を進め、急性肝障害の新たな治療法としてEVsの活用の検討を進めていきます。
用語解説
- (注1)間葉系幹細胞(Mesenchymal Stem Cell:MSC)
- さまざまな細胞に分化する多様性を持つ幹細胞の一つであり、自己複製能を持つ。近年では細胞・再生医療の細胞源として注目されている。
- (注2)細胞外小胞(Extracellular vesicles:EVs)
- 細胞から放出される核を持たない脂質二重膜で囲まれた粒子。細胞外小胞は産生機構の違いから、エクソソーム、マイクロベシクル、アポトーシス小胞に分類されている。
- (注3)好中球
- 好中球は白血球の一種で、急性細菌感染症や特定の真菌感染症に対して体を守るという大きな役割を果たす。一般に好中球は、血液中にある全白血球の約45~75%を占める。
- (注4)多価不飽和脂肪酸(polyunsaturated fatty acid:PUFA)
- 不飽和結合を2つ以上有する不飽和脂肪酸であり、二重結合の位置によりω3系(ドコサヘキサエン酸:DHAやエイコサペンタエン酸:EPAなど)やω6系(アラキドン酸:AA)などに分類される。
- (注5)GOT(Glutamic Oxaloacetic Transaminase、グルタミン酸オキサロ酢酸トランスアミナーゼ)
- 生体内では肝細胞や筋線維などに多く存在し、細胞が破綻した際に血液中に放出されることから、肝障害の指標とされる。
- (注6)GPT(Glutamic Pyruvic Transaminase、グルタミン酸ピルビン酸転移酵素)
- 生体内の多くの組織に含まれるが、肝細胞に特に多く存在し、肝細胞の障害により血液中に放出される。
- (注7)単球系細胞
- 白血球の一種で単球/マクロファージや樹状細胞、クッパー細胞などを含む。異物に対する貪食作用をもつほか、貪食した抗原を他の免疫担当細胞へ提示することにより免疫能を支持する。
- (注8)クッパー細胞(Kupffer Cells:KCs)
- 肝臓の類洞に存在する単球系細胞の一つ。免疫担当細胞として異物の除去などに関わるほか、組織の線維化や再生などにも関わることが報告されている。
- (注9)サイトカイン
- サイトカインとは主に免疫系細胞から分泌されるタンパク質で、標的細胞表面に存在する特異的受容体を介して極めて微量で生理作用を示し、細胞間の情報伝達を担う。その中でも白血球の遊走などを引き起こすサイトカインの一群はケモカインとよばれる。
- (注10)RT-PCR(リアルタイムPCR)
- リアルタイムPCRは定量的PCRの一つ。ポリメラーゼ連鎖反応による増幅を経時的に測定することで、増幅率に基づいて鋳型となるDNAの定量を行なう。
論文情報
- 論文タイトル
- “Human hepatocyte-derived extracellular vesicles attenuate the carbon tetrachloride-induced acute liver injury in mice”
(ヒト肝細胞由来の細胞外小胞はマウスにおける四塩化炭素誘発性急性肝障害を軽減する)
お問い合わせ先
研究に関すること
東海大学医学部 基盤診療学系 先端医療科学 教授
幸谷愛(コウタニ アイ)
〒259-1193 神奈川県伊勢原市下糟屋143
Tel:0463-93-1121(内線2781)
E-mail:aikotani“AT”k-lab.jp
報道担当
東海大学 広報担当
喜友名浩史(キユナ ヒロシ)
〒259-1292 神奈川県平塚市北金目4-1-1
Tel:0463-58-1211(代表)
E-mail:pr“AT”tsc.u-tokai.ac.jp
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーション・グループ
保田睦子(ヤスダ ムツコ)
〒102-0076 東京都千代田区五番町7 K’s五番町
Tel:03-3512-3524 Fax:03-3222-2064
E-mail:crest“AT”jst.go.jp
報道担当
科学技術振興機構(JST) 広報課
〒102-8666 東京都千代田区四番町5番地3
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkoho“AT”jst.go.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル
Tel:03-6870-2225
E-mail:hepatitis“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年10月26日
最終更新日 令和3年10月26日


