遺伝性脳小血管病に対するカンデサルタンの有効性を確認―脳動脈硬化の新たな治療法として期待―
プレスリリース
新潟大学
理化学研究所
日本医療研究開発機構
新潟大学脳研究所分子神経疾患資源解析学分野の加藤泰介准教授、同脳神経内科学分野の小野寺理教授、理化学研究所生命医科学研究センター応用ゲノム解析技術研究チームの眞鍋理一郎上級研究員らの研究グループは、遺伝性の脳小血管病(※1)の一つである、CARASIL(皮質下梗塞と白質脳症を伴う常染色体劣性遺伝性脳動脈硬化症)が、マトリソームタンパク質(※2)の蓄積による加齢性の血管硬化によって発症するという新たな分子メカニズムを発見し、カンデサルタン(※3)の投与によって、CARASILモデルマウスの脳血管機能障害が治療可能であることを発見しました。本研究成果は、今後の脳小血管病に対する治療法開発の基盤になることが期待されます。
本研究成果のポイント
- CARASILモデルマウス、CARASIL患者さんでは、血管の内膜でマトリソームが蓄積していました。
- CARASILモデルマウスでは、マトリソーム蓄積による血管の硬化と脳血流の低下が認められました。
- カンデサルタン投与がCARASILモデルマウスのマトリソームの蓄積を抑制して、血管機能を正常化することを発見しました。
研究の背景
脳小血管病は、加齢や高血圧に伴って、脳の細い動脈(脳小動脈)が硬化し、歩行障害や認知症を来す疾患です。高齢者には、程度の差こそあれ、よく認められます。しかし、その有効な治療方法は見出されていません。常染色体劣性遺伝形式(※4)の脳小動脈硬化症を引き起こすCARASILは、セリンプロテアーゼ(※5)であるhigh-temperature requirement serine peptidase A1(以下、HTRA1)の異常によって起こり、20-30代で発症し、40代には自力歩行が難しくなり、重度の認知症を来します。またヘテロ接合体(※6)でも50代過ぎに発症することが知られています。イギリスでは450人に1人が、HTRA1の遺伝子に問題となる変異を持っているとされ、この変異が脳小動脈硬化によって生じる脳白質異常と関係が示されたことにより、HTRA1の機能障害と脳小血管病との関連が注目されています。日本においても、まだ多くHTRA1の異常と関連する症例が見逃されていると考えられています。
脳小動脈は、内膜(内腔側)と中膜から成り、その間に内弾性板が存在します。CARASILでは内膜の肥厚や内弾性板の断裂、中膜の変性という、加齢性脳小動脈硬化症と類似の変化を認めます。しかし、何故HTRA1の異常が脳小動脈硬化を引き起こすかは分かっていませんでした。
研究の概要・成果
要約
今回、本研究グループは、遺伝性脳小血管病CARASILのモデルマウスの脳血管を解析し、このマウスの血管壁にマトリソームが蓄積し、脳血管の硬化、脳血流の低下が起こることを発見しました。また、CARASILの患者さんでも、マトリソームが蓄積していることを見出しました。
さらに、本研究グループは、降圧薬であるカンデサルタンにマトリソームを調節する機能があることに注目し、その効果を検証しました。その結果、カンデサルタンは、CARASILモデルマウスのマトリソームの蓄積を抑制し、血管の硬化、脳血流の低下を抑制させました。
マトリソームの異常は、加齢性の脳動脈硬化でも認められます。脳動脈硬化は、認知症の原因として3番目に多く、またアルツハイマー型認知症と高頻度に合併します。脳血管の硬化保護という視点から今回の研究成果は、これらに対する新しい予防方法となる可能性があります。
本文
まず、本研究グループは、CARASILのモデルマウスであるHTRA1遺伝子欠損マウス(HTRA1−/−マウス)脳血管の解析を実施しました。その結果、高齢のHTRA1−/−マウスで、内膜の肥厚、内弾性板(エラスチン層)の重層化、血管の硬化、脳血流の低下を認めました(図1、2)。次にHTRA1−/−マウスの脳動脈を用いて、質量分析法(※7)による網羅的なタンパク質の定量解析を行いました。その結果、HTRA1−/−マウスで389種のタンパク質の増加が認められ、そのうち40%(155種)がフィブロネクチン(以下、FN)、LTBP-4、fibulin-5、エラスチン、TIMP3等の、マトリソーム構成タンパク質であることが分かりました。さらにタンパク質ネットワーク解析(※8)の結果、FNが、この蓄積マトリソーム内ネットワークの中心である事が判明しました。HTRA1−/−マウスの電子顕微鏡や免疫組織学的な解析から、同定されたマトリソーム群が、肥厚した内膜に蓄積していることが分かりました。
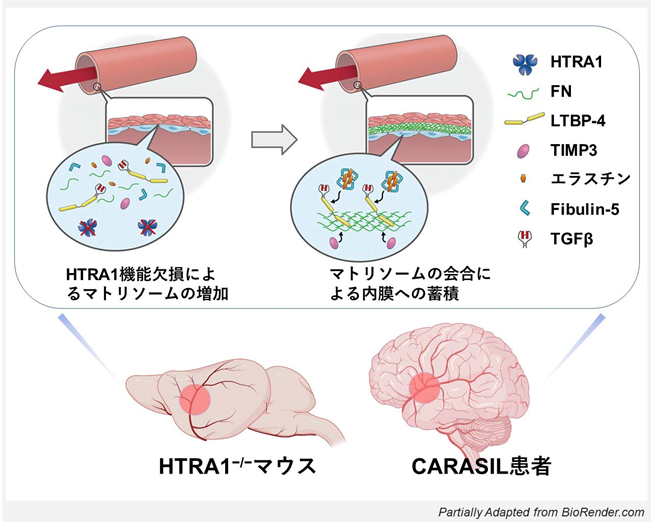
次に、CARASIL患者さんの剖検脳におけるマトリソームの蓄積を評価しました。HTRA1−/−マウスで観察された結果と同様に、脳小動脈の肥厚した内膜にFN、LTBP-4、fibulin-5などの蓄積を認め、実際のCARASIL患者さんにおいても、マトリソームの蓄積が起きていることが示されました(図1)。
一方、これまでCARASILの発症に関与することが指摘されてきたTGF-βシグナル(※9)の変動は、HTRA1−/−マウス脳血管組織内では見られず、さらに、RNAシーケンス(※10)解析でも、遺伝子の発現に明らかな変化は同定されませんでした。本研究グループは、蓄積が同定されたFNを含むマトリソームタンパク質の一部が、HTRA1の分解基質であることから、HTRA1機能低下によるマトリソームタンパク質の蓄積が、CARASILの原因であり、治療標的となり得ると考えました。
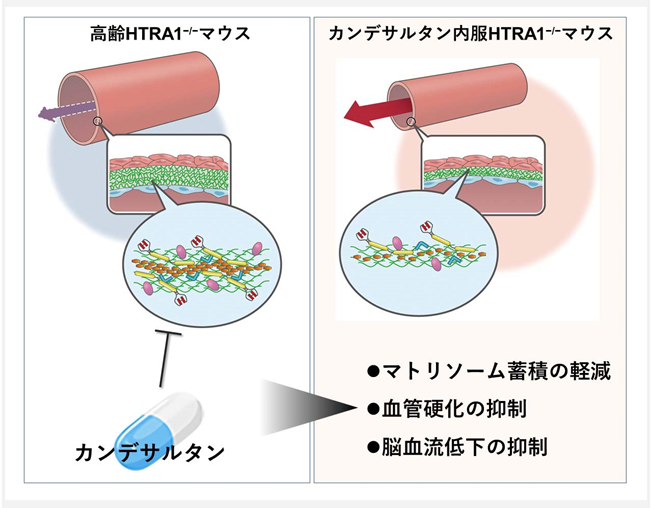
そこで次に、マトリソームタンパク質蓄積による組織線維化、特にFN線維化形成を阻害することで知られるカンデサルタンをHTRA1−/−マウスに投与し、その治療効果を検証しました。カンデサルタンの投与は、マトリソームタンパク質の蓄積が始まる4ヵ月齢から開始し、脳小血管病の病態が発症する高齢期(20ヵ月齢~)に、その効果を判定しました。その結果、カンデサルタン投与群では、FN、LTBP-4、fibulin-5、エラスチン、TIMP3といったマトリソームタンパク質の血管内膜への蓄積が有意に低下することが分かりました(図2)。質量分析による網羅的な解析では、増加していた145個のマトリソームタンパク質のうち、88個(60.7%)の蓄積が抑制されていることが明らかとなり、カンデサルタンには非常に効果的にマトリソーム蓄積を軽減させる効果があることが分かりました。さらに、カンデサルタンを投与したHTRA1−/−マウスでは、血管内膜の肥厚が軽減しており、血管の硬化が抑制され、脳血流も正常化していました(図2)。
以上より、カンデサルタンは、HTRA1−/−マウスで生じる脳小血管のマトリソームの異常を軽減し、硬化や脳血流低下是正することが分かりました。
今後の展開
本研究により、CARASILはマトリソームの異常によって発症することが示され、その治療薬にはカンデサルタンが有力になり得ることが示されました。CARASILで認められる動脈の変化は、加齢性の脳小動脈硬化症に類似し、CARASILでもFNの蓄積が報告されています。今後、マトリソームの調節を通した、脳小動脈硬化の進行を抑制・緩和するという、これまでにない治療コンセプトをより幅広い疾患に応用できる可能性があります。
研究成果の公表
本研究成果は、2021年11月15日正午(米国東部時間)に、科学雑誌「Journal of Clinical Investigation」誌に掲載されました。「Journal of Clinical Investigation」誌は、医学の進歩につながる基礎的および臨床的な生物医科学の発見が掲載される、権威ある医学系研究雑誌です。
- 論文タイトル
- Candesartan prevents arteriopathy progression in cerebral autosomal recessive arteriopathy with subcortical infarcts and leukoencephalopathy model.
- 著者
- Taisuke Kato, Ri-ichiroh Manabe, Hironaka Igarashi, Fuyuki Kametani, Sachiko Hirokawa, Yumi Sekine, Natsumi Fujita, Satoshi Saito, Yusuke Kawashima, Yuya Hatano, Shoichiro Ando, Hiroaki Nozaki, Akihiro Sugai, Masahiro Uemura, Masaki Fukunaga, Toshiya Sato, Akihide Koyama, Rie Saito, Atsushi Sugie, Yasuko Toyoshima, Hirotoshi Kawata, Shigeo Murayama, Masaki Matsumoto, Akiyoshi Kakita, Masato Hasegawa, Masafumi Ihara, Masato Kanazawa, Masatoyo Nishizawa, Shoji Tsuji, and Osamu Onodera
- doi
- 10.1172/JCI140555
謝辞
本研究は、文部科学省科学研究費補助金 新学術領域研究「脳タンパク質老化と認知症制御」、日本医療研究開発機構(AMED)難治性疾患実用化研究事業、脳科学研究戦略推進プログラム(脳プロ)、日本学術振興会 科学研究費助成事業 基盤研究(A)、若手研究(B)、日本学術振興会先端バイオイメージング⽀援プラットフォーム(ABiS)、日本学術振興会 コホート・生体試料支援プラットフォーム、厚生労働科学研究費補助金「遺伝性脳小血管病の病態機序の解明と治療法の開発」、武田科学振興財団研究助成の支援を受けて行われました。
用語解説
- (※1)脳小血管病
- 脳の細い動脈によって、脳の循環は制御されています。内膜と中膜の2層構造で、間に内弾性板があります。大きさによって、軟膜血管、細動脈、毛細血管となり、細くなると内弾性板が消失します。この脳小血管を選択的に侵す疾患が脳小血管病です。ラクナ梗塞、白質病変などを呈します。
- (※2)マトリソーム
- 私たちの体を構成している細胞の間は様々なタンパク質で構成される特殊な構造(細胞外マトリックス)で満たされています。細胞と細胞の間のクッションのようなイメージです。ここに他のタンパク質をためたり、組織の固さを調節したりしています。この細胞外マトリックスを構成する蛋白質の集団のことをマトリソームといいます。線維構造をとったタンパク質が主体で、ここに蓄積するタンパク質群を含めたタンパク質群の総称を指します。
- (※3)カンデサルタン
- アンジオテンシンⅡタイプ1(AT1)受容体拮抗薬の一つで、降圧薬として用いられています。
- (※4)常染色体劣性遺伝形式
- 2対ある遺伝子(対立遺伝子)の両方に同様の特性があるときに初めて現れる遺伝形式。疾患に関わる遺伝子であれば、両遺伝子に疾患に関連する変異があって初めて発症します。
- (※5)セリンプロテアーゼ
- タンパク質を分解する酵素であるプロテアーゼの中で、酵素の活性を担う構造の中心(活性中心)にアミノ酸の一種であるセリンを持つものを指します。
- (※6)ヘテロ接合体
- 2対ある遺伝子(対立遺伝子)が同一ではない遺伝子を持つ個体のこと。疾患に関わる変異であれば、片側の遺伝子のみ疾患関連変異があり、もう片側が正常であることを指します。
- (※7)質量分析法
- 質量分析は、物質に電荷を持たせたイオンの状態にして(イオン化)、物質の同定や定量を行う方法です。今回の研究では、断片化したタンパク質をイオン化して同定、定量するプロテオミクスという方法を用いました。
- (※8)タンパク質ネットワーク解析
- 既知のタンパク質とタンパク質の相互作用の情報から、与えられたタンパク質集団の中で、どのタンパク質が機能的に重要であるかを推測する手法です。同様の原理が、ソーシャルネットワークや貿易ネットワーク等、様々なネットワークの中心(どれが重要か?)を探索することに用いられています。
- (※9)TGF-βシグナル
- トランスフォーミング増殖因子(Transforming Growth Factor-β:TGF-β)タンパク質によって惹起される細胞間の情報伝達。一連の遺伝子発現を誘導します。組織の修復などにおいて働きます。TGF-βはHTRA1の基質として知られます。
- (※10)RNAシーケンス
- 次世代シーケンサーによって、サンプル内の、全てのRNAの配列と個数(コピー数)を解析するシーケンス法。トランスクリプトーム解析とも呼ばれます。
本件に関するお問い合わせ先
研究に関すること
新潟大学脳研究所分子神経疾患資源解析学分野
准教授 加藤泰介(かとう たいすけ)
Tel:025-227-0682
E-mail:taisuke8077“AT”bri.niigata-u.ac.jp
新潟大学脳研究所脳神経内科学分野
教授 小野寺理(おのでら おさむ)
E-mail:onodera“AT”bri.niigata-u.ac.jp
広報担当
新潟大学広報室
Tel:025-262-7000
E-mail:pr-office“AT”adm.niigata-u.ac.jp
理化学研究所広報室報道担当
E-mail:ex-press“AT”riken.jp
AMED事業に関すること
日本医療研究開発機構
創薬事業部創薬企画・評価課 難治性疾患実用化研究事業担当
E-mail:nambyo-r“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和3年11月16日
最終更新日 令和3年11月16日


