プレスリリース タンパク質分解誘導剤依存的な相互作用解析技術の開発―低分子化合物よって相互作用するタンパク質の網羅的な探索が可能―
プレスリリース
愛媛大学
徳島大学
名古屋工業大学
日本医療研究開発機構
背景
標的タンパク質のみを分解誘導することができるタンパク質分解誘導剤1)は、疾患を引き起こすタンパク質を細胞から除去できるため“次世代の治療薬”として期待されています。サリドマイド2)やその誘導体(Immunomodulatory drugs/IMiDs3))に代表されるタンパク質分解誘導剤は、タンパク質分解酵素であるE3ユビキチンリガーゼ4)の構成因子のひとつであるセレブロン(CRBN)へ結合することにより、特定のタンパク質の分解を誘導し、その結果、薬理作用および副作用を示すことが明らかとなっています。IMiDsは“分子糊”のように機能することで、E3ユビキチンリガーゼと標的タンパク質を近接させ分解誘導することから、Molecular glue(分子糊)型のタンパク質分解誘導剤と呼ばれています。
多発性骨髄腫を中心に、年間約1兆円の規模で利用されているIMiDsの臨床的成功により、分子糊型のタンパク質分解誘導剤は多くの疾患の魅力的な化合物となっています。さらに現在では、IMiDsのようなE3ユビキチンリガーゼに結合する化合物(E3バインダー)と標的タンパク質へ結合する化合物(標的バインダー)を繋ぎ合わせたキメラ化合物であるPROTACs(Proteolysis targeting chimeras)5)型のタンパク質分解誘導剤が開発されています。PROTACs型タンパク質分解誘導剤の開発によって、これまでに治療薬の標的にすることが困難であったタンパク質を標的にすることが可能であり、大きな期待が持たれています。これらの背景から、E3ユビキチンリガーゼに相互作用し分解誘導されるタンパク質を解析することは、タンパク質分解誘導剤の開発や臨床応用において極めて重要です。
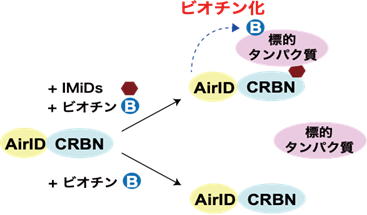
これまでに、タンパク質分解誘導剤の標的タンパク質を高精度に探索する技術の開発は遅れていました。本研究グループは、昨年、タンパク質相互作用解析に有用な近位依存性ビオチン化標識(BioID)6)酵素としてAirID(ancestral BirA for proximity-dependent biotin identification)7)の開発に成功しました(参考文献1)。さらに、AirID融合CRBNを用いることで、IMiDs依存的な標的タンパク質のビオチン8)化が可能であることを報告しています(図1)(参考文献1)。これらの成果から、AirIDを用いたタンパク質分解誘導剤依存的に相互作用する標的タンパク質を網羅的に解析する評価系の着想を得ました。
研究成果
本研究では、CRBNのようなE3ユビキチンリガーゼへAirIDを融合することで、タンパク質分解誘導剤依存的に相互作用する標的タンパク質をビオチン化することが可能であることを示しました。ビオチン化されたタンパク質・ペプチドは、ストレプトアビジン9)や抗ビオチン化抗体を利用した質量分析法による網羅的な解析系が開発されています。本研究では、アビジン様タンパク質であるタマビジン2-REV10)を用いたビオチン化ペプチドの濃縮法が、タンパク質分解誘導剤依存的な相互作用解析技術に有用であることを示しました(図2)。本解析技術を用いることで、タンパク質分解誘導剤の標的タンパク質や、化合物の選択性を評価できることが示されました(図3)。また、様々な培養細胞を用いた解析の結果、IMiDsであるポマリドミド11)依存的に分解誘導される標的タンパク質としてZMYM2(zinc finger MYM-type protein 2)を見出し(図4)、血液がんを引き起こすZMYM2-FGFR1融合タンパク質も分解誘導されることを明らかにしました(図5)。さらに、本解析技術はIndisulam12)やPROTACsのようなこれまでに報告されているタンパク質分解誘導剤にも利用可能であることを確認できました(図6)。
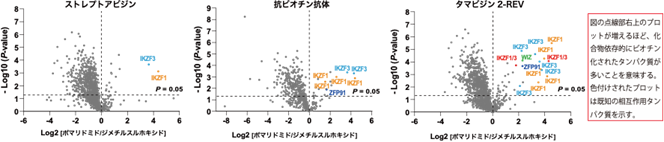
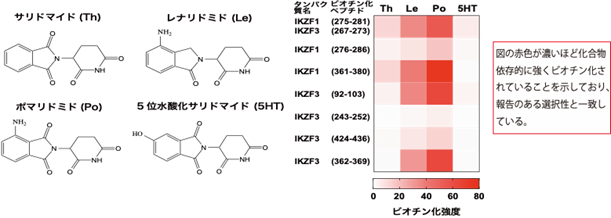
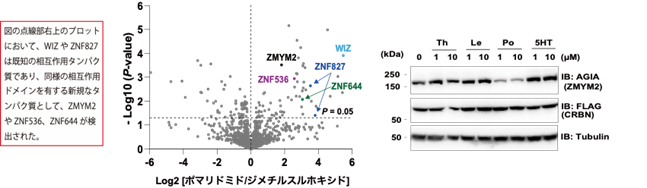
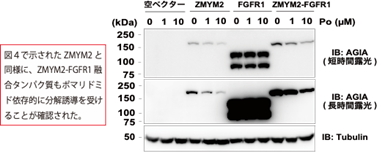
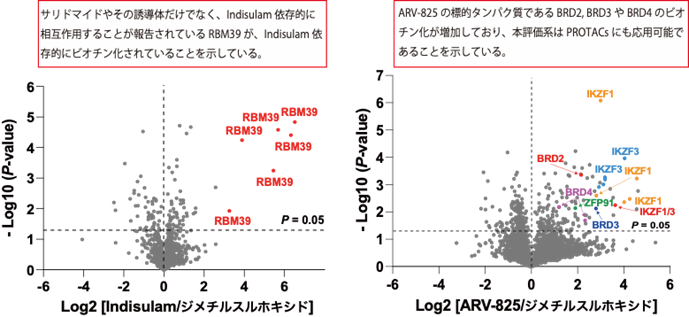
これらの結果から、AirIDをE3ユビキチンリガーゼに融合することで、細胞内のタンパク質分解誘導剤依存的に相互作用するタンパク質を網羅的に同定・解析できることが示されました。
波及効果
AirIDを用いた本解析技術は、今後開発される多様な分子糊型およびPROTACs型のタンパク質分解誘導剤の解析へ利用可能です。現在、様々な疾患を対象に様々なタンパク質分解誘導剤が開発されており、いくつかのタンパク質分解誘導剤は現在臨床段階にあります。しかしながら、タンパク質分解誘導剤の強力な作用を考慮すると、副作用を引き起こす本来の目的ではないタンパク質との相互作用を評価することは絶対に必要です。実際、本研究においても、様々なタンパク質がタンパク質分解誘導剤依存的に相互作用することが示唆されました。これらの結果から、本解析技術を利用することで、タンパク質分解誘導剤の作用機序の解明や副作用を回避した化合物開発に繋がることが期待されます。
研究体制と支援について
本研究は、愛媛大学 プロテオサイエンスセンター、徳島大学 先端酵素学研究所 藤井節郎記念医科学センター、名古屋工業大学大学院工学研究科との共同研究としておこなわれました。
また、研究の実施にあたっては、日本医療研究開発機構(AMED)次世代がん医療創生事業(P-CREATE)「催奇性を回避した血液がん治療に有効な新規サリドマイド誘導体の開発」、新学術領域研究「ケモテクノロジーが拓くユビキチンニューフロンティア」、新学術領域研究「数理解析に基づく生体シグナル伝達システムの統合的理解」、日本学術振興会(JSPS)科学研究費助成事業若手研究「近接ビオチン化酵素を用いたサリドマイドのインタラクトーム解析技術の開発」、武田科学振興財団、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)「コムギ無細胞系による構造解析に適した複合体タンパク質生産・調製技術と低分子抗体作製技術の創出」、徳島大学先端酵素学研究所共同利用・共同研究拠点事業の支援を受けました。
論文タイトルと著者
- 掲載誌
- Nature Communications
- Journal link
- http://www.nature.com/ncomms
- DOI
- 10.1038/s41467-021-27818-z
- タイトル
- A proximity biotinylation-based approach to identify protein-E3 ligase interactions induced by PROTACs and molecular glues
(和訳)PROTACsやMolecular gluesによって誘発されるタンパク質-E3リガーゼ間相互作用を同定するための近位依存性ビオチン化を基盤としたアプローチ - 著者
- 山中 聡士(愛媛大学)、堀内 雄斗(愛媛大学)、松岡 沙耶(愛媛大学)、城戸 康希(愛媛大学)、西野 耕平(徳島大学)、前野 万也香(研究当時:名古屋工業大学)、柴田 哲男(名古屋工業大学)、小迫 英尊(徳島大学)、澤崎 達也(愛媛大学)
- 掲載日
- 2022年1月10日(月)
用語説明
- 1)タンパク質分解誘導剤
- 細胞内のタンパク質分解システムをハイジャックし、標的タンパク質を分解誘導する化合物。疾患に関与するタンパク質を分解誘導するという新たな作用機序を切り開いた化合物であり、近年の創薬研究において注目されている。
- 2)サリドマイド
- 睡眠作用および免疫調整作用を持つ低分子薬剤であり、多発性骨髄腫などの血液がんやハンセン病による2型らい反応に対する治療薬として利用されている。
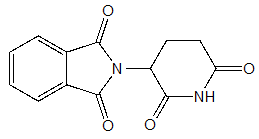
図7.サリドマイドの化学構造 - 3)Immunomodulatory drugs/IMiDs
- サリドマイドやその誘導体の総称であり免疫調整薬とも呼ばれる。イカロスやアイオロスと呼ばれるタンパク質の分解を引き起こし、多発性骨髄腫などの血液がんに対する治療薬として世界中で使用されている。
- 4)E3ユビキチンリガーゼ
- タンパク質のユビキチン化を引き起こす酵素。細胞内でユビキチン化されたタンパク質はプロテアソームによって分解される。
- 5)PROTACs(Proteolysis targeting chimeras)
- E3ユビキチンリガーゼに相互作用する低分子化合物(E3バインダー)と標的タンパク質に相互作用する(標的バインダー)をリンカーで繋ぎ合わせたキメラ化合物である。疾患に関与する標的タンパク質を分解誘導するという新たな作用機序を有する化合物であり、標的タンパク質を触媒反応によって徹底的に細胞内から除去するため、効果が強力である。また、これまで薬剤の標的にすることが困難であった酵素活性を持たないようなタンパク質も標的となり得る。
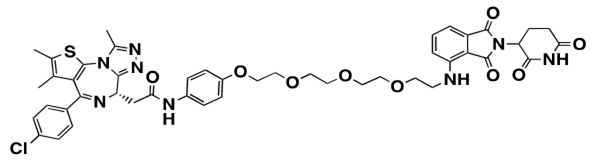
図8.本研究で用いたPROTACの化学構造 - 6)近位依存性ビオチン標識(BioID)
- タンパク質相互作用解析技術の一つ。近位依存性ビオチン標識酵素(例えばAirID)を融合したタンパク質を発現させ、ビオチンを添加するだけの簡便な反応により、全タンパク質レベルの網羅的な相互作用解析を可能とする。簡便かつマイルドな条件での解析が可能であり、生きた細胞や生物個体を用いた解析も可能なため、大変注目されている。
- 7)AirID(ancestral BirA for proximity-dependent biotin identification)
- 従来のBioID技術に用いられているビオチン化酵素BirAを基に、進化工学的手法を用いて開発された新規近位依存性ビオチン標識酵素である。従来のBioID酵素と比較して高いビオチン化活性を有することが報告されている。
- 8)ビオチン
- 本来はビタミンの一種であるが、タンパク質の標識によく利用されている化学物質。アビジンと呼ばれるタンパク質と強力な相互作用を形成することが知られており、ビオチン標識したタンパク質はアビジンを用いて容易に回収できる。
- 9)ストレプトアビジン
- 放線菌の一種であるストレプトマイセス由来のタンパク質であり、ビオチンと高い親和性で相互作用する。ストレプトアビジン–ビオチン間の強力な相互作用を利用して、様々な解析に用いられている。
- 10)タマビジン 2-REV
- キノコから単離されたアビジン様タンパク質であるタマビジン2を遺伝子改変した変異体であり、従来のアビジン–ビオチン間の相互作用では用いることが不可能であった、過剰なビオチンによる競合溶出が可能である。
- 11)ポマリドミド
- サリドマイド誘導体であり、免疫調整薬IMiDsとして多発性骨髄腫などの血液がんに使用されている低分子薬剤である。イカロスやアイオロスと呼ばれるタンパク質を強力に分解誘導する。
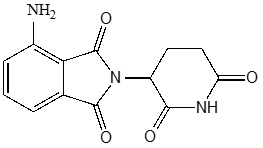
図9.ポマリドミドの化学構造 - 12)Indisulam
- 抗がん活性を有するスルホンアミド化合物であり、大腸がん細胞HCT116を含む広範囲のヒト腫瘍株に対して抗増殖効果を示す。IndisulamはMolecular glue型のタンパク質分解誘導剤であり、E3ユビキチンリガーゼ構成因子であるDCAF15と相互作用することによって、RNA結合モチーフタンパク質RBM39を分解誘導する。
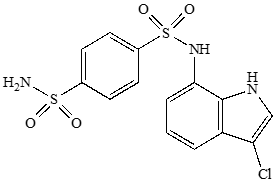
図10.Indisulamの化学構造
- 参考文献1
- Kido, K., Yamanaka, S., Nakano, S., Motani, K., Shinohara, S., Nozawa, A., Kosako, H., Ito, S., and *Sawasaki, T. (2020)AirID, a novel proximity biotinylation enzyme, for analysis of protein-protein interactions. eLife 9, e54983. doi: 10.7554/eLife.54983.
お問い合わせ先
研究内容に関する問い合わせ先
愛媛大学プロテオサイエンスセンター
教授 澤崎 達也
TEL:089-927-8530
Mail:sawasaki“AT”ehime-u.ac.jp
愛媛大学プロテオサイエンスセンター
特定研究員 山中 聡士
TEL:089-927-8567
Mail:yamanaka.satoshi.ze“AT”ehime-u.ac.jp
徳島大学先端酵素学研究所藤井節郎記念医科学センター
教授 小迫 英尊
TEL:088-634-6413
Mail:kosako“AT”tokushima-u.ac.jp
名古屋工業大学大学院工学研究科
教授 柴田 哲男
TEL:052-735-7543
Mail:nozshiba“AT”nitech.ac.jp
大学に関する問い合わせ先
愛媛大学 総務部広報課広報チーム
TEL:089-927-9022
Mail:koho“AT”stu.ehime-u.ac.jp
徳島大学 総務部総務課
TEL:088-656-7021
Mail:kohokakaricho“AT”tokushima-u.ac.jp
名古屋工業大学 企画広報課
TEL:052-735-5647
Mail:pr“AT”adm.nitech.ac.jp
AMED事業に関する問い合わせ先
日本医療研究開発機構(AMED)創薬事業部医薬品研究開発課
次世代がん医療創生研究事業(P-CREATE)
TEL:03-6870-2311
Mail:cancer“AT”amed.go.jp
※Mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年1月11日
最終更新日 令和4年1月11日


