プレスリリース 真核生物の遺伝子発現制御を担う酵素が染色体の基盤構造に結合した様子を解明―様々な疾患の発症メカニズムの解明や創薬への応用に期待―
プレスリリース
科学技術振興機構(JST)
日本医療研究開発機構(AMED)
発表者
畠澤 卓(東京大学大学院理学系研究科 生物科学専攻 博士課程3年)
滝沢 由政(東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野 准教授)
胡桃坂 仁志(東京大学定量生命科学研究所 先端定量生命科学研究部門 クロマチン構造機能研究分野 教授)
発表のポイント
- 発表者らの研究チームは、主要なアセチル化酵素(注1)の一つであるp300が、ゲノムDNAを収納しているヌクレオソーム(注2)に結合した様子を世界で初めて解明しました。
- p300はヌクレオソームの様々な位置に結合可能であることが明らかになり、この性質によってp300は多様なヒストンアセチル化(注3)に機能していることが示唆されました。
- p300によるヒストンアセチル化の制御異常は、がんを含む様々な疾患を引き起こすことから、本研究で得られた知見は創薬に向けて応用されることが期待されます。
発表概要
研究の背景、研究手法と成果、将来の展望など
東京大学大学院理学系研究科の畠澤卓 大学院生、東京大学定量生命科学研究所クロマチン構造機能研究分野の滝沢由政 准教授、胡桃坂仁志 教授らの研究チームは、コロラド大学のTatiana Kutateladze教授との共同研究で、細胞の恒常性維持に重要なタンパク質であるp300の活性ドメインと、ヒトのゲノムDNA収納の基盤構造であるヌクレオソームが結合した複合体の構造を世界で初めて解明しました。
ヒトをはじめとする真核生物のゲノムDNAは、ヒストン複合体に巻き付いてヌクレオソームを形成し、これが数珠状に連なることでクロマチンを形成して細胞核内に収納されています。ヒストンのアセチル化はクロマチン構造を変化させることで、DNAの塩基配列に依存しない後成的な遺伝子制御(注4)を担っています。p300は主要なヒストンアセチル化酵素であり、多様なヒストンのアセチル化を介して特定の遺伝子の活性化を誘導することで、細胞機能の正常な維持に貢献しています。しかし、p300がどのようにヌクレオソームに結合して、クロマチンにおいてヒストンのアセチル化を触媒するのか、そのメカニズムは不明でした。
そこで本研究チームは、試験管内で再構成したヌクレオソームと、アセチル基転移活性中心(注5)を含むp300ドメイン(p300活性ドメイン)の複合体を調製し、クライオ電子顕微鏡(注6)によってその複合体構造群を明らかにしました。その結果、p300活性ドメインはヌクレオソーム上の様々なポジションに結合することが分かりました。この性質によって、p300の特徴であるヌクレオソーム中の多様なヒストンのアセチル化が可能となっていると考えられました。他のアセチル化酵素においては、これまでにヌクレオソーム上の定まった位置での結合様式が報告されています。本研究ではこのような結合様式とは異なった、p300独自の結合様式を明らかにすることができました。p300によるヒストンアセチル化の制御異常は、がんや神経変性を引き起こすことが知られています。本研究で得られた知見によって、疾患モデル細胞におけるp300の制御異常に関する理解が進み、これらの疾患の発症メカニズムの解明や治療方法の確立につながることが期待されます。
本研究は、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「胡桃坂クロマチンアトラスプロジェクト」(研究総括:胡桃坂仁志、JPMJER1901)をはじめ、日本学術振興会(JSPS)の新学術領域研究「遺伝子制御の基盤となるクロマチンポテンシャル」(代表:胡桃坂仁志、JP18H05534)、「革新的なクロマチン基盤膜を用いたクライオ電子顕微鏡3次元構造解析」(代表:滝沢由政、JP19K06522)、「クロマチン上で起こる転写と共役した二重鎖切断修復の分子機構の解明」(代表:胡桃坂仁志、JP20H00449)、国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)「エピジェネティクス研究と創薬のための再構成クロマチンの生産と性状解析」(代表:胡桃坂仁志、JP21am0101076)、および生命科学・創薬研究支援基盤事業(BINDS)「エピジェネティクスの基盤原理解明と創薬のためのヒストンおよび再構成クロマチンの生産」(代表:胡桃坂仁志、JP22ama121009)などの支援を受けて行われました。また、クライオ電子顕微鏡解析は、AMED BINDS(代表:吉川雅英、JP20am0101115)からの支援を受けて実施されました。
発表内容
研究の背景・先行研究における問題点
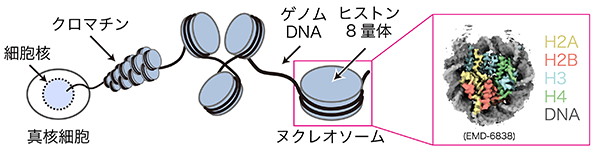
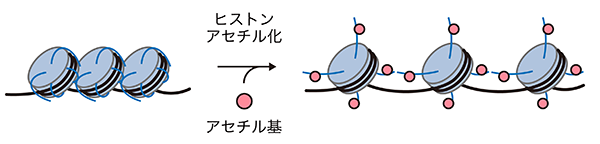
生命の設計図としての役割を担うゲノムDNAは、4種類のヒストンを2分子ずつ含むヒストン複合体に巻き付くことで、ヌクレオソームという円盤状の構造を形成します。このヌクレオソームは数珠状に連なることでクロマチンを形成し、長大なゲノムDNAを細胞の核内に収納しています(図1)。クロマチンは様々な要因によってその構造を変化させ、これによってDNAの塩基配列に依存しない後成的な遺伝子制御の中心を担っています。ヒストン修飾はクロマチンの構造を変化させる要因の一つであり、酵素の働きによって様々な官能基がヒストンに付加される現象です。ヒストン修飾の一種であるヒストンアセチル化は、一般的にはクロマチン構造を弛緩させることで遺伝子の活性化に寄与しています(図2)。p300は4種類のヒストンをアセチル化する主要なヒストンアセチル化酵素であり、アセチル化されたゲノム領域周辺の遺伝子を活性化することで、細胞の恒常的な活動に機能することが知られています。このようにp300はヒストンアセチル化によって遺伝子を後成的に制御し、細胞機能の正常な維持に貢献しています。しかしながら、p300がヌクレオソームにどのように結合して多様なヒストンのアセチル化を行うのか、そのメカニズムについては明らかにされていませんでした。
研究内容
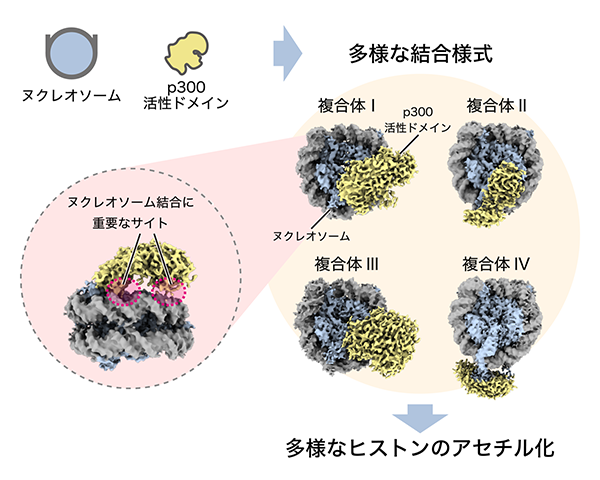
東京大学定量生命科学研究所の胡桃坂仁志 教授らの研究チームは、クライオ電子顕微鏡解析によって、p300の活性ドメインがヌクレオソームに結合している様子を明らかにしました。研究チームはまず、試験管内で再構成したヌクレオソームと、精製したp300活性ドメインを反応させ、両者が結合した複合体を精製しました。この複合体の立体構造を、クライオ電子顕微鏡を用いて解析し、ヌクレオソームにp300活性ドメインが結合した様子を明らかにしました。その結果、ヌクレオソームの様々な位置にp300活性ドメインが結合した複合体の立体構造が得られました(図3)。さらに、得られた立体構造情報と生化学的な結合試験によって、p300活性ドメインのヌクレオソーム結合に重要なアミノ酸領域を同定しました。本研究で明らかになったp300活性ドメインの多様なヌクレオソーム結合様式によって、p300による様々なヒストンのアセチル化が可能となっていることが考えられました。
社会的意義
p300はヒストンのアセチル化を介した遺伝子発現の制御によって、発生や分化などのさまざまな生命活動に機能しています。加えて、p300によるヒストンアセチル化の制御異常は、がんや神経変性の原因であることも知られています。したがって、本研究で得られた知見は、これらの疾患の発症メカニズムの解明や治療方法の確立に貢献することが期待されます。
発表雑誌
- 雑誌名
- 「iScience」(オンライン版:2022年6月8日)
- 論文タイトル
- Structural basis for binding diversity of acetyltransferase p300 to the nucleosome
- 著者
- Suguru Hatazawa†, Jiuyang Liu†, Yoshimasa Takizawa†, Mohamad Zandian, Lumi Negishi, Tatiana G. Kutateladze, and Hitoshi Kurumizaka*
(※第一著者に†、責任著者に*) - DOI番号
- 10.1016/j.isci.2022.104563
- URL
- https://www.cell.com/iscience/fulltext/S2589-0042(22)00835-5
用語解説
- (注1)アセチル化酵素
- 標的となるタンパク質基質にアセチル基を付加する酵素の総称。タンパク質はアセチル基の導入によって活性や細胞内局在などが変化し、その機能が制御されているものが存在する。
- (注2)ヌクレオソーム
- 真核生物のゲノムDNA収納様式であるクロマチンの基盤構造。4種類のヒストンタンパク質(H2A、H2B、H3、H4)が2分子ずつ含まれるヒストン8量体に、ゲノムDNAが約1.7周巻き付いた構造体。
- (注3)ヒストンアセチル化
- ヒストンにアセチル基が付加される現象。アセチル基の導入によってヒストンの塩基性電荷が中和され、ヌクレオソーム中のヒストンとDNAの間の相互作用が低下し、クロマチン構造が弛緩する。
- (注4)後成的な遺伝子制御
- ゲノムDNAの塩基配列以外の要因による遺伝子制御。ヒストンの翻訳後修飾やDNAのメチル化などによる遺伝子制御が知られている。この制御によって、同一のゲノムDNA配列情報を持つ細胞が多様な細胞や組織に分化することが可能となっているほか、細胞の恒常性維持などが担保されている。
- (注5)アセチル基転移活性中心
- 基質に対するアセチル基の付加反応に直接関わるアセチル化酵素の部位。p300の場合、1467番目のアミノ酸であるチロシンがアセチル基転移に中心的に機能している。
- (注6)クライオ電子顕微鏡
- 液体窒素冷却下で電子線をタンパク質などの生体分子に照射し、試料の観察を行う装置。試料を急速凍結してクライオ電子顕微鏡で観察することで、溶液状態に近い構造を得ることができる。近年では急速な技術革新によって、高分解能でのタンパク質立体構造解析が可能となった。
お問い合わせ先
本研究に関するお問い合わせ
東京大学 定量生命科学研究所
教授 胡桃坂 仁志(クルミザカ ヒトシ)
Tel:03-5841-7826 Fax:03-5841-1468
E-mail:kurumizaka“AT”iqb.u-tokyo.ac.jp
報道に関するお問い合わせ
東京大学 定量生命科学研究所 総務チーム
Tel:03-5841-7813 Fax:03-5841-8465
E-mail:soumu“AT”iqb.u-tokyo.ac.jp
科学技術振興機構 広報課
Tel:03-5214-8404 Fax:03-5214-8432
E-mail:jstkoho“AT”jst.go.jp
JST事業に関するお問い合わせ
科学技術振興機構 研究プロジェクト推進部 ICT/ライフイノベーショングループ
今林 文枝(イマバヤシ フミエ)
Tel:03-3512-3528 Fax:03-3222-2068
E-mail:eratowww“AT”jst.go.jp
AMED事業に関するお問い合わせ
日本医療研究開発機構(AMED)
生命科学・創薬研究支援基盤事業(BINDS)創薬事業部 医薬品研究開発課
Tel:03-6870-2219 Fax:03-6870-2244
E-mail:20-DDLSG-16“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年6月10日
最終更新日 令和4年6月10日


