プレスリリース 新型コロナウイルスの新たな細胞侵入経路とその阻害薬の発見―COVID-19の複雑な病態解明・治療薬開発に期待―
プレスリリース
東京大学
日本医療研究開発機構
発表者
山本 瑞生(東京大学医科学研究所 附属アジア感染症研究拠点 特任講師)
合田 仁(東京大学医科学研究所 附属アジア感染症研究拠点 特任准教授)
越川 直彦(東京工業大学生命理工学院 健康医療科学分野 教授)
清木 元治(東京大学名誉教授)
仙波 憲太郎(早稲田大学先進理工学部 生命医科学科 教授)
秋山 徹(東京大学定量生命科学研究所 分子情報研究分野 特任教授)
川口 寧(東京大学医科学研究所 附属アジア感染症研究拠点 拠点長/感染・免疫部門 ウイルス病態制御分野 教授)
井上 純一郎(東京大学名誉教授、特命教授)
発表のポイント
- 新型コロナウイルスが、メタロプロテアーゼ(注1)というタンパク質分解酵素を利用して細胞に感染することを明らかにするとともに、安全性が確認されている複数の薬剤がこの感染を効果的に阻害することを見出した。
- メタロプロテアーゼによる感染は、SARSやMERSコロナウイルスなどには見られない新型コロナウイルスに特有な感染経路であり、ウイルス外膜に存在するSpikeタンパク質(注2)の特徴的な構造に依存することを明らかにした。
- COVID-19は肺などの呼吸器だけでなく血管や腎臓などの全身性の病態を示すことが分かっており、新型コロナウイルスに特有なメタロプロテアーゼ依存性の感染経路の解析はCOVID-19の複雑な病態の解明や治療法の開発に役立つことが期待される。
発表概要
新型コロナウイルスはウイルス外膜と細胞の膜(細胞膜やエンドソーム膜)を融合させて感染します。この膜融合には細胞の膜上の受容体とタンパク質分解酵素(プロテアーゼ)が重要です。東京大学医科学研究所附属アジア感染症研究拠点の山本瑞生特任講師、合田仁特任准教授、東京大学の井上純一郎名誉教授・特命教授らは、既に膜融合への関与が知られていたセリンプロテアーゼやシステインプロテアーゼに依存しない新たな感染経路を発見しました。
この新規経路はメタロプロテアーゼに依存し、SARSやMERSコロナウイルスなどには見られない新型コロナウイルス特有の経路です。さらに研究グループは癌転移抑制剤として開発が進んでいた複数のメタロプロテアーゼ阻害薬がこの経路を効果的に阻害し、COVID-19の病態に関連するウイルス感染依存性細胞融合や細胞死を抑制することを見出しました。
以上の成果は新型コロナウイルスの素早い感染拡大の機構やCOVID-19の複雑な病態の解明に繋がるだけでなく、重症化や後遺症などに対する治療法開発や新たな変異株の病原性予測にも役立つことが期待されます。本研究成果は2022年6月16日、米国科学雑誌「mBio」オンライン版に公開されました。
本研究は日本医療研究開発機構(AMED) 新興・再興感染症研究基盤創生事業・海外拠点研究領域(JP21wm0125002)、創薬等ライフサイエンス研究支援基盤事業(JP20am0101086, サポート番号2480)、日本学術振興会 新学術領域研究(16H06575)、基盤研究C(20K07610)、東京大学新型コロナウイルス感染症対策実用化推進助成の支援の下で実施されました。
発表内容
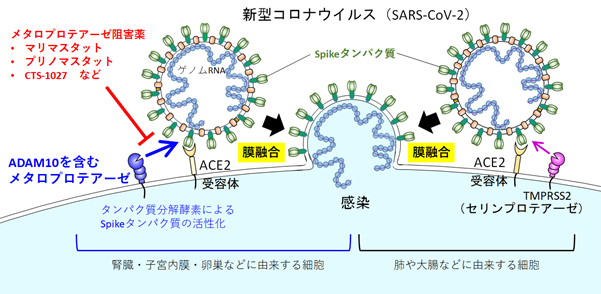
新型コロナウイルス感染症(COVID-19)では、呼吸器だけでなく血管・腎臓・脳など様々な組織へのウイルス感染がその複雑な病態に関与していると考えられます。新型コロナウイルスが細胞に感染するためにはウイルス外膜と細胞の膜(細胞膜やエンドソーム膜)を融合させてウイルス遺伝子を細胞内へ侵入させる必要があります。それにはウイルス外膜のSpikeタンパク質が細胞膜上の受容体ACE2に結合し、その後にSpikeタンパク質が細胞に発現するタンパク質分解酵素(プロテアーゼ)によって部分的に切断され活性化することが重要です。これまでに細胞膜上に発現するセリンプロテアーゼTMPRSS2やエンドソーム内に発現するシステインプロテアーゼCathepsin B/LによるSpikeタンパク質の切断・活性化が報告されていましたが、他のプロテアーゼの関与は報告されておらず、過去に局地的に感染が広がったSARSやMERSコロナウイルスと今回全世界的に感染拡大している新型コロナウイルスの感染機構における違いは明らかになっていませんでした。
研究グループは、ウイルス外膜と細胞膜の融合を評価する膜融合アッセイ系を用いてナファモスタット(フサン)などの感染阻害薬を同定してきました(Yamamoto M. et al, Viruses 2020, 12(6), 629)。今回このアッセイ系を用いて、新型コロナウイルスのSpikeタンパク質がSARSやMERSコロナウイルスのSpikeタンパク質とは異なり、TMPRSS2非依存性に膜融合を誘導することを発見しました。そこで東京大学創薬機構から分与された既存薬・分子標的薬など約3000種類の化合物ライブラリーを用いたスクリーニングを行い、イロマスタット、CTS-1027といった広範なメタロプロテアーゼに対する阻害薬がTMPRSS2非依存性の膜融合を効果的に阻害することを見出し、何らかのメタロプロテアーゼがこの膜融合に重要であることを明らかにしました。
メタロプロテアーゼはMMP(Matrix metalloproteinase)やADAM(a disintegrin and metalloproteinase)ファミリーなどを含むタンパク質分解酵素の総称であり、これまでに固形癌の転移や浸潤等への関与が示されてきました。以前に癌転移や浸潤の阻害を目的としてマリマスタットやプリノマスタットというメタロプロテアーゼ阻害薬の臨床試験が行われ、これらの体内投与における一定の安全性が確認されてきました。そこでこれらの臨床応用が期待されるメタロプロテアーゼ阻害薬について新型コロナウイルスのSpikeタンパク質による膜融合への阻害効果を検討したところ、TMPRSS2非依存性の膜融合を特異的に阻害することが分かりました。
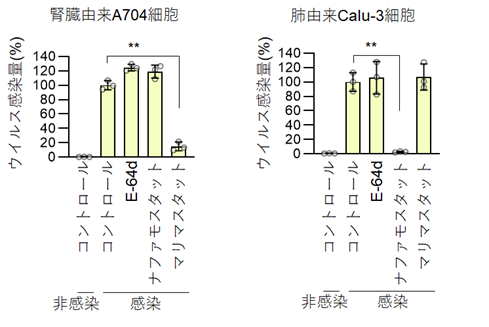
次に、このメタロプロテアーゼ依存性の膜融合がどのような組織由来の細胞で感染に重要かを調べるためにSpikeタンパク質を発現するシュードウイルス(注3)を用いて様々な細胞株におけるマリマスタットの感染阻害効果を解析しました。その結果、マリマスタットは腎臓や子宮内膜および卵巣由来の細胞株においてシュードウイルスの感染を効果的に抑制しましたが、肺や大腸由来の細胞株では抑制効果を示しませんでした。これにより、メタロプロテアーゼによる新型コロナウイルス感染には細胞特異性があることがわかりました(図2)。
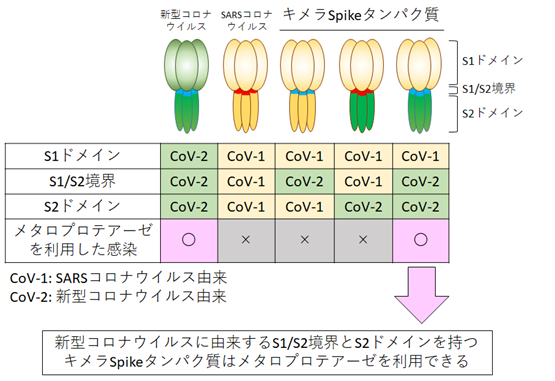
さらに研究グループは、高病原性コロナウイルスの中で新型コロナウイルスのSpikeタンパク質のみがメタロプロテアーゼを利用できる機構を調べるために、Spikeタンパク質の構造が類似しているにもかかわらずメタロプロテアーゼを利用した感染を起こせないSARSコロナウイルスのSpikeタンパク質と部分的に構造を入れ替えたキメラSpikeタンパク質をもつシュードウイルスを作成して比較しました(図3)。その結果メタロプロテアーゼを利用して感染するためにはSpikeタンパク質が、S1とS2の2つのドメインの境界にFurinというタンパク質分解酵素に切断される新型コロナウイルス由来の配列を持つこと、および新型コロナウイルスのSpikeタンパク質のC末端側のS2ドメインを持つこと、の両方が必要なことを見出しました。
一方で標的細胞側の因子を同定するために特異的な阻害薬や遺伝子ノックダウン法を用いて解析を行い、細胞膜上で働くADAM10というメタロプロテアーゼが重要な働きを持つことを明らかにしました。
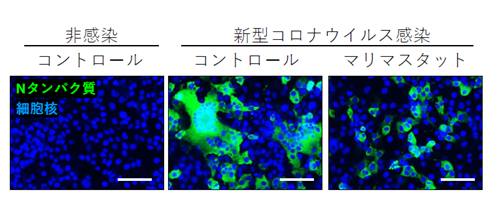
最後にマリマスタットやプリノマスタットが過去の臨床試験で用いられた血中濃度以下の濃度で新型コロナウイルス感染に依存した細胞融合や細胞死を抑制することを見出しました(図4)。細胞融合や細胞死はCOVID-19の様々な病態に関わる可能性があり、メタロプロテアーゼの治療標的としての重要性を示唆しています。
本研究から、局地的な感染拡大に留まったSARSやMERSコロナウイルスとは異なり、新型コロナウイルスはSpike遺伝子に複数の特徴を持つことでADAM10を含むメタロプロテアーゼを利用した感染機構を獲得、全世界的なパンデミックを起こし複雑な病態を誘導するように進化した可能性が示唆されました。本研究の成果は新型コロナウイルスの感染拡大の機構や様々な組織に感染し障害を起こすCOVID-19の複雑な病態の解明に繋がるだけでなく、重症化や後遺症などの様々な病態に対する治療法の開発や新たな変異株の病原性の予測に役立つことが期待されます。
- 参考文献
- Yamamoto M, Kiso M, Sakai-Tagawa Y, Iwatsuki-Horimoto K, Imai M, Takeda M, Kinoshita N, Ohmagari N, Gohda J, Semba K, Matsuda Z, Kawaguchi Y, Kawaoka Y, Inoue JI. The anticoagulant nafamostat potently inhibits SARS-CoV-2 S protein-mediated fusion in a cell fusion assay system and viral infection in vitro in a cell-type-dependent manner. Viruses 2020, 12(6): 629.
- Spikeタンパク質による細胞融合を解析することで新型コロナウイルスの感染をナファモスタット(フサン)が効果的に抑制することを明らかにした研究。
発表雑誌
- 雑誌名
- mBio(2022年6月16日オンライン版)
- 論文タイトル
- Metalloproteinase-dependent and TMPRSS2-independent cell surface entry pathway of SARS-CoV-2 requires the furin-cleavage site and the S2 domain of spike protein
- 著者
- Mizuki Yamamoto, Jin Gohda, Ayako Kobayashi, Keiko Tomita, Youko Hirayama, Naohiko Koshikawa, Motoharu Seiki, Kentaro Semba, Tetsu Akiyama, Yasushi Kawaguchi and Jun-ichiro Inoue*
(*Corresponding author) - DOI番号
- 10.1128/mbio.00519-22
- URL
- https://journals.asm.org/doi/10.1128/mbio.00519-22
用語解説
- (注1)メタロプロテアーゼ
- タンパク質分解酵素(プロテアーゼ)の一種でMMP (Matrix metalloproteinase)ファミリーやADAM (a disintegrin and metalloproteinase)ファミリーなどのプロテアーゼ群の総称。酵素活性中心に金属イオンが結合することからこう呼ばれる。マリマスタット、プリノマスタットなどの低分子阻害薬は様々なメタロプロテアーゼ活性を抑制することが知られている。
- (注2)Spikeタンパク質
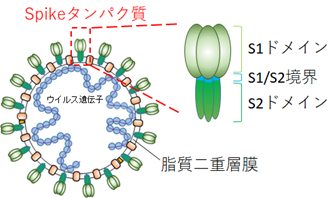
- 新型コロナウイルスは外膜(エンベロープ)と呼ばれる脂質二重層膜上にSpikeタンパク質を持っており、Spikeタンパク質はN末端側から受容体ACE2との結合に重要なS1ドメイン、Furinプロテアーゼによって切断を受けるS1/S2境界、標的細胞との膜融合に重要なS2ドメインの3つのドメインから成る。このSpikeタンパク質は2段階の切断を受けることが知られている。まず感染細胞内で合成され、FurinによってS1とS2の2つのドメインに切断されてウイルス外膜に取り込まれる。その後、感染の際に細胞の受容体にS1ドメインが結合したのちにプロテアーゼによってS2ドメインが2段階目の切断をうけて活性化し、細胞の膜に結合してウイルス外膜と細胞の膜の融合を引き起こす。このためSpikeタンパク質のプロテアーゼによる切断が感染に重要である。
- (注3)シュードウイルス
- シュードウイルスは新型コロナウイルス(SARS-CoV-2)などコロナウイルスのSpikeタンパク質を別のウイルス外膜に発現することでSpikeタンパク質依存的に標的細胞に感染するが、標的細胞内で増えることが出来ない安全性の高い実験用のウイルスである。本研究では様々なSpikeタンパク質による感染経路を比較する目的で用いている。
お問い合わせ先
研究についてのお問い合わせ
東京大学医科学研究所 附属アジア感染症研究拠点
特任講師 山本 瑞生 (やまもと みずき)
Tel:03-6409-2206
E-mail:mizuyama"AT"ims.u-tokyo.ac.jp
報道についてのお問い合わせ
東京大学医科学研究所 国際学術連携室(広報)
担当:清水
E-mail:koho"AT"ims.u-tokyo.ac.jp
AMED事業についてのお問い合わせ
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
新興・再興感染症研究基盤創生事業(海外拠点研究領域)担当
Tel:03-6870-2225
E-mail:jprogram"AT"amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年6月17日
最終更新日 令和4年6月17日


