成果情報 皮膚バリアの形成に必須なセラミドの結合メカニズムを解明―先天性魚鱗癬の治療薬の新規開発に期待―
成果情報
名古屋大学
日本医療研究開発機構
名古屋大学大学院医学系研究科皮膚科学の武市拓也講師、秋山真志教授、Department of Pharmacology and the Vanderbilt Institute of Chemical Biology、Vanderbilt UniversityのAlan R. Brash教授、公益財団法人東京都医学総合研究所細胞膜研究室の平林哲也主席研究員らの研究グループは、SDR9C7というタンパク質が、皮膚バリアの形成に必須なセラミド※1の結合において重要な働きをしていることを解明しました。
本研究グループは、SDR9C7遺伝子の変異を持つ先天性魚鱗癬※2の患者と、Sdr9c7遺伝子(人のSDR9C7遺伝子と相同性の高いマウスの遺伝子)を人為的に破壊したマウス(Sdr9c7欠損マウス)の皮膚組織について、詳細な脂質成分の分析を行い、それぞれ対照である健常人の皮膚組織に比較して、主に角層細胞脂質エンベロープ(corneocyte lipid envelope:CLE)※3を担っている結合型セラミドの含有量が低下していることを明らかにしました。更に、SDR9C7タンパク質が直接関与する脂質の代謝経路を見つけるために、野生型のSDR9C7タンパク質と先天性魚鱗癬の患者に見られる変異型のSDR9C7タンパク質を作製し、それぞれの酵素の活性を測定しました。その結果、SDR9C7タンパク質は、アシルセラミド※4が持つ脂肪酸のアルコール基をケトン基へ変換する、脱水素反応を触媒する酵素であることを突き止めました。また、変異型のSDR9C7タンパク質では、この経路の酵素活性において著しい低下が見られました。
周辺帯タンパク質※5と角層細胞間脂質層※6を結びつけ、皮膚のバリアの要として働くセラミドの層であるCLEは、皮膚のバリアにとって最も重要な構造の一つです。本研究の結果より、角層※7の周辺帯タンパク質とCLEの結合に、SDR9C7タンパク質が重要な働きをしていることが明らかになりました。患者の皮膚でSDR9C7タンパク質の機能低下が起こると、角層の周辺帯タンパク質へCLEがうまく結合できなくなり、皮膚バリアに障害が生じて先天性魚鱗癬を発症します。
本研究により、皮膚バリアの形成の詳細なメカニズムが明らかになるとともに、難病である先天性魚鱗癬のみならず、皮膚バリアの障害によって起きるアトピー性皮膚炎や他のアレルギー疾患の病態の解明と、SDR9C7タンパク質を標的とした新規治療法の開発が期待されます。
本研究成果は 2019年10月31 日(米国東部時間)に「The Journal of Clinical Investigation」に掲載されました。
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山信治)における研究開発課題「脂質による体表面バリア形成の分子機構の解明」(研究開発代表者:木原章雄、研究期間:平成27年度~令和2年度 )の支援によって行われたものです。
ポイント
- SDR9C7というタンパク質が、皮膚バリアの形成に必要なセラミドの結合において重要な働きをしていることを、本研究で解明しました。
- 今回の発見により、SDR9C7タンパク質をコードするSDR9C7遺伝子の変異により生じる先天性魚鱗癬が、皮膚バリアを形成する過程での異常により引き起こされることが明らかになりました。
- 本研究の成果により、難病である先天性魚鱗癬のみならず、皮膚バリアの障害によって起きるアトピー性皮膚炎や他のアレルギー疾患の病態の解明と、SDR9C7タンパク質を標的とした新規治療法の開発が期待されます。
背景
皮膚の最も外側にある層の角層は、皮膚のバリアや水分保持の機能に重要な役割を持つことが知られています。その角層は、角質細胞※8とその細胞間を埋める角層細胞間脂質層で形成されていますが、角層細胞の辺縁にある周辺帯タンパク質と角層細胞間脂質層は、それぞれ、タンパク質と脂質という異質な成分であり、それらがバラバラに存在していてはバリアとして機能できません。そこで、脂質の中でも特異な構造を持つセラミドが、周辺帯タンパク質と角層細胞間脂質層を架橋して、皮膚のバリアを完成させているのです。この架橋するセラミドの層は角質細胞脂質エンベロープ(corneocyte lipid envelope:CLE)と呼ばれますが、皮膚のバリアにとって最も重要な構造の一つです。ところが、これまで、セラミドがCLEを形成する際に周辺帯タンパク質と結合するメカニズムは、明らかになっていませんでした。
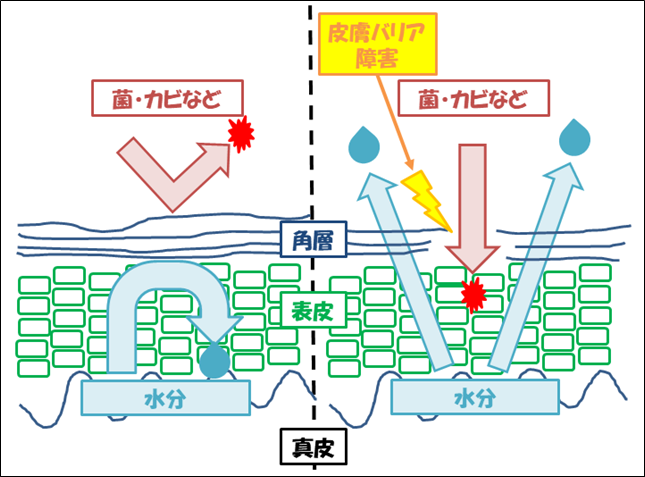
一方、皮膚のバリア機能は、病原体やアレルゲンなどの侵入を阻止する生体の防護壁のような役割と、体内の水分が体外に出ていくのを防ぐ保湿機能としての役割を担っています。そのため、皮膚のバリア機能の異常はアトピー性皮膚炎や先天性魚鱗癬などの皮膚疾患を引き起こします。先天性魚鱗癬とは、生まれた時から皮膚の表面がめくれて赤くなったり、厚く、硬くなったりする病気です。患者によって程度の違いはありますが、皮膚の症状は多くの患者では生涯に渡って続きます。2016年に先天性魚鱗癬の新たな原因遺伝子としてSDR9C7遺伝子が報告されましたが、SDR9C7遺伝子の変異が先天性魚鱗癬を引き起こすメカニズムは明らかになっていませんでした。
今回の研究では、セラミドがCLEを形成する際に周辺帯タンパク質と結合するメカニズムと、SDR9C7遺伝子の変異が先天性魚鱗癬を引き起こすメカニズムを明らかにするために、SDR9C7遺伝子の変異を持つ先天性魚鱗癬の患者と、Sdr9c7遺伝子を人為的に破壊したマウス(Sdr9c7欠損マウス)について、遺伝子発現差の解析、形態学的な分析、脂質成分の分析などを行い詳細に病態を解析しました。さらに、野生型のSDR9C7タンパク質と先天性魚鱗癬の患者に見られる変異型のSDR9C7タンパク質について、それらの酵素活性を測定して両者を比較しました。
研究成果
私たちは先ず、既に病気の原因と認められている遺伝子に変異を認めない先天性魚鱗癬患者のDNAを用いて全エクソームシークエンス解析※9を行い、未報告であるSDR9C7遺伝子の変異を同定しました。また、この患者の皮膚組織では、健常人と比較してSDR9C7タンパク質の発現が明らかに減っていました。患者から採取した皮膚の角層に関する脂質成分の分析では、対照である健常人の角層に比較して、主にCLEを担っている結合型のセラミドの含有量の低下が認められました。
次に私たちは、Sdr9c7遺伝子を人為的に破壊したマウス(Sdr9c7欠損マウス)を樹立しました。そしてSdr9c7欠損マウスと野生型マウスの間で脂質成分の分析を行いました。その結果、Sdr9c7欠損マウスの皮膚組織では、野生型マウスと比較して結合型のセラミドの含有量が低下していることが分かりました。またSdr9c7欠損マウスでは、ケトン体の脂肪酸を持つアシルセラミドのほぼ完全な損失と、野生型マウスではほとんど見られないトリオールの脂肪酸を持つアシルセラミドの蓄積が認められました。
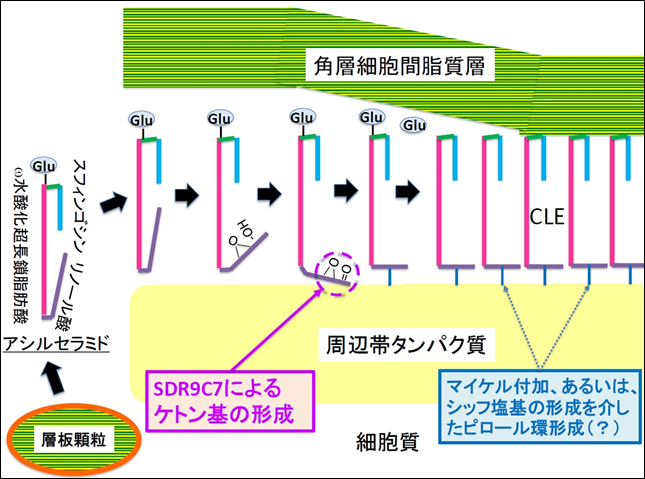
更に、SDR9C7タンパク質が直接関与する脂質の代謝経路を見つけるために、私たちは野生型のSDR9C7タンパク質と先天性魚鱗癬の患者に見られる変異型のSDR9C7タンパク質を作製し、酵素活性を測定しました。その結果、SDR9C7タンパク質は、アシルセラミドが持つ脂肪酸のアルコール基をケトン基へ変換する、脱水素反応を触媒する酵素であることを突き止めました。また変異型のSDR9C7タンパク質は、この経路の酵素活性において著しい低下が見られました。
これらの結果より、角層の周辺帯タンパク質とCLEの結合に、SDR9C7タンパク質が重要な働きをしていることが明らかになりました。SDR9C7タンパク質によって産生される、ケトン体の脂肪酸を持つアシルセラミドは、特定の酵素反応を必要とせず、マイケル付加※10あるいはシッフ塩基※11の形成を介したピロール環※12の形成により、周辺帯タンパク質と結合すると考えられます。患者の皮膚でSDR9C7タンパク質の機能低下が起こると、角層で周辺帯タンパク質へCLEがうまく結合できなくなり、皮膚バリアに障害が生じて先天性魚鱗癬を発症します。
今後の展開
今回の研究成果から、SDR9C7タンパク質が皮膚バリアの形成過程において非常に重要な働きをしていることが明らかになりました。本研究の成果により、皮膚バリアの形成の詳細なメカニズムが明らかになるとともに、難病である先天性魚鱗癬のみならず、皮膚バリアの障害によって起きるアトピー性皮膚炎や他のアレルギー疾患の病態の解明と、SDR9C7タンパク質を標的とした新規治療法の開発が期待されます。
用語説明
- ※1 セラミド
- 皮膚の最外層に位置する角層は、脂質を多く含んでいて、皮膚のバリア機能や水分保持機能に重要な役割を持つことが知られています。角層の主な脂質は、セラミド、コレステロール、遊離脂肪酸等で形成されており、その約50%をセラミドが担っています。これまでに、このセラミドの代謝経路に関わるさまざまな遺伝子の変異が、先天性魚鱗癬の原因遺伝子として報告されています。
- ※2 先天性魚鱗癬
- 生まれつき皮膚の表面が厚く、硬くなる、稀な遺伝性の皮膚疾患で、厚生労働省の指定難病に指定されている疾患の一つ。近年の分子生物学技術の進歩により、先天性魚鱗癬の病因遺伝子が次々に解明されています。しかし、未だに原因遺伝子の異常が先天性魚鱗癬の臨床像を来すそのメカニズムについては、不明な点が多く残されています。先天性魚鱗癬の多くの患者は、生涯に渡って、皮疹、掻痒や亀裂による疼痛に悩まされますが、未だに有効な治療法は確立されていません。
- ※3 角層細胞脂質エンベロープ(corneocyte lipid envelope:CLE)
- 角層を構成している角質細胞と、角層細胞間脂質層を結びつけている構造物。周辺帯タンパク質にセラミドが共有結合した結合型セラミドで構成されます。
- ※4 アシルセラミド
- 層板顆粒より放出される角層細胞間脂質層を構成する脂質の中で、最も重要な働きをすると考えられている脂質群です。セラミドのω-水酸基にリノール酸が結合しており、非常に高い疎水性を持っています。
- ※5 周辺帯タンパク質
- 角層細胞の細胞膜は、内側からの多数の小さなタンパク質が結合した、周辺帯という裏打ち構造を持っています。この裏打ち構造により角層細胞は補強され、バリアとしてしっかりと働くことができます。周辺帯を形成するタンパク質は、角層細胞間脂質と共に、いろいろな物理的または化学的な障害から生体を守るだけでなく、同時に生体からの水分の過剰な喪失を防ぐ、皮膚バリア機能の要としての役割を担っています。
- ※6 角層細胞間脂質層
- 角層を形成している角質細胞の細胞間を埋めている脂質層のこと。角化細胞が角質細胞へと脱核する際に、細胞質内の層板顆粒に蓄えられていた脂質が細胞外に分泌され、角層細胞間脂質層が形成されています。
- ※7 角層
- 外界と体内を分け隔てており、皮膚の再外層に位置する、およそ10層で形成される構造物。角層は主に、角質細胞と、その角質細胞の間に存在している角層細胞間脂質からなります。角層が剥がれ落ちたものが、いわゆる「垢」となります。
- ※8 角質細胞
- 角層を形成している細胞のこと。表皮を形成する角化細胞が、角化の過程で核がなくなって角質細胞となり、角質細胞が角層として堆積します。
- ※9 エクソームシークエンス解析
- 遺伝子変異解析に用いられる次世代シークエンス技術と呼ばれる研究手法の一つ。DNA中のエクソン領域のみを解析することにより、効率のよい遺伝子診断が可能となります。
- ※10 マイケル付加
- ケトン体のような電子不足のα,β-不飽和カルボニル化合物に対して、求核剤を1, 4付加させる生化学的な反応のことです。酵素を必要としない反応です。
- ※11 シッフ塩基
- 有機化合物の分類のひとつで、窒素原子に炭化水素基が結合したイミンの呼称。
- ※12 ピロール環
- 五員環構造を持つ複素環式芳香族化合物のアミンの一種。
発表雑誌
- 掲載紙:
- The Journal of Clinical Investigation
- 論文名:
- SDR9C7 catalyzes critical dehydrogenation of acylceramides for skin barrier formation
- 著者:
- Takuya Takeichi1, Tetsuya Hirabayashi2,Yuki Miyasaka3, Akane Kawamoto4, Yusuke Okuno5, Shijima Taguchi6, Kana Tanahashi1, Chiaki Murase1, Hiroyuki Takama7, Kosei Tanaka8, William E. Boeglin9, M. Wade Calcutt10, Daisuke Watanabe7, Michihiro Kono1, Yoshinao Muro1, Junko Ishikawa4, Tamio Ohno3, Alan R. Brash9 and Masashi Akiyama1
- 所属:
-
- Department of Dermatology, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Laboratory of Biomembrane, Tokyo Metropolitan Institute of Medical Science, Tokyo, Japan
- Division of Experimental Animals, Nagoya University Graduate School of Medicine, Nagoya, Japan
- Biological Science Research Laboratories, Kao Corporation, Haga, Tochigi, Japan
- Medical Genomics Center, Nagoya University Hospital, Nagoya, Japan
- Division of Dermatology, Mito Kyodo General Hospital, Mito, Ibaraki, Japan
- Department of Dermatology, Aichi Medical University, Nagakute, Japan
- Analytical Science Research Laboratories, Kao Corporation, Haga, Tochigi, Japan
- Department of Pharmacology and the Vanderbilt Institute of Chemical Biology, Vanderbilt University, Nashville, Tennessee, USA
- Department of Biochemistry, Vanderbilt University, Nashville, Tennessee, USA
- DOI:
- 10.1172/JCI130675.
お問い合わせ先
研究について
名古屋大学医学部・医学系研究科
皮膚科 講師 武市 拓也
TEL: 052-744-2314 FAX:052-744-2318
E-mail:takeichi”AT”med.nagoya-u.ac.jp
広報担当
名古屋大学医学部・医学系研究科総務課総務係
TEL:052-744-2228 FAX:052-744-2785
E-mail:iga-sous”AT”adm.nagoya-u.ac.jp
AMED事業に関するお問い合わせ先
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
〒100-0004東京都千代田区大手町1-7-1 読売新聞ビル
TEL:03-6870-2224
E-mail:kenkyuk-ask”AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年1月22日
最終更新日 令和2年1月22日


