臨床用iPS細胞を用いたパーキンソン病治療の非臨床研究
成果情報
京都大学iPS細胞研究所(CiRA)
日本医療研究開発機構
ポイント
- 臨床用のiPS細胞ストックから作製したドパミン神経前駆細胞注1)を使用して、パーキンソン病に対する細胞移植治療の医師主導治験のための非臨床安全性・有効性試験を行いました。
- 臨床で使用できるiPS細胞由来細胞製剤について、再現性のある製造方法を確立しました。
- 細胞製剤を免疫不全マウスへ移植して1年間経過観察し、移植細胞による腫瘍形成や毒性が認められないことを確認しました。
- 細胞製剤を免疫不全ラットや霊長類のパーキンソン病モデル動物に移植し、ドパミン神経細胞の生着や行動改善を確認しました。
要旨
人工多能性幹細胞(iPS細胞)由来のドパミン(DA)神経細胞は、パーキンソン病(PD)に対する細胞移植治療の材料として期待されています。しかし、多能性幹細胞を用いた細胞製剤の臨床応用に関する規制基準は標準化されていません。
今回、京都大学iPS細胞研究所の土井大輔特定拠点助教(CiRA臨床応用研究部門)、髙橋淳教授(CiRA同部門)の研究グループは、臨床用ヒトiPS細胞に由来するドパミン神経前駆細胞(DAP)の安全性と有効性を確認し、臨床試験のための品質規格を確立しました(図1)。DAPの特性をin vitroで解析したところ、未分化なiPS細胞や増殖性の初期神経幹細胞が含まれておらず、癌関連遺伝子にも異常はありませんでした。さらに、免疫不全マウスを用いたin vivo試験では、細胞の造腫瘍性や毒性は認められませんでした。またDAPをPDモデルラットの線条体に移植したところ、異常回転運動が改善しました。これらの結果に基づいて、PD患者に対する細胞移植治療の臨床試験(医師主導治験)を2018年に開始しました。
この研究成果は2020年7月6日午後6時(日本時間)に英国科学誌「Nature Communications」でオンライン公開されました。
研究の背景
パーキンソン病(PD)は中脳黒質-線条体系のドパミン神経細胞が脱落し、運動緩慢、振戦、筋強剛を中心とした運動症状が前景となる神経変性疾患で、本邦では約17万人の患者さんがいます。発症初期にはLドパ投与などの薬物療法が著効しますが、病気の根本治療ではないため、病期の進行に伴い効果の減弱や副作用が認められます。外科的治療として微小電極を使用したDBS(脳深部刺激治療)がありますが、同様に長期的には効果が減弱します。そこで、失われたドパミン神経細胞を移植により補充する細胞移植治療はより根治的な新たな治療法の一つとして期待され、ヒトの胎児細胞を使用した欧米の臨床試験では症例によっては運動症状が改善し薬物治療が不要になるなどの効果が認められています。ただし胎児細胞には細胞供給の問題や倫理的な問題があるため、代わりとしてヒト多能性幹細胞(ES細胞・iPS細胞)が細胞の供給源として期待され世界中で研究が行われてきました。
これまでにヒトの多能性幹細胞からドパミン神経細胞を作製する培養方法が開発され、げっ歯類や霊長類のPDモデルで有効性が示されており臨床で使用可能な段階まで研究が進んできました。ただし、多能性幹細胞を用いた細胞治療を行うためのルールが世界で標準化されておらず、それぞれの国での異なる規制基準によって臨床応用が行われています。すでにヒトES細胞を用いたPDに対する臨床試験がオーストラリア及び中国で開始されており、本研究グループは日本での臨床試験を開始しました。PDに対する細胞治療を標準化するためには非臨床試験や臨床試験の結果を共有することが重要です。細胞移植治療では移植された細胞は脳内に生着してドパミン神経として機能することが期待されるため、厳格な管理が必要と考えられます。この論文では、ヒトiPS細胞由来ドパミン神経前駆細胞の安全性・有効性を確認するために実施した非臨床試験の結果をまとめました。
研究結果
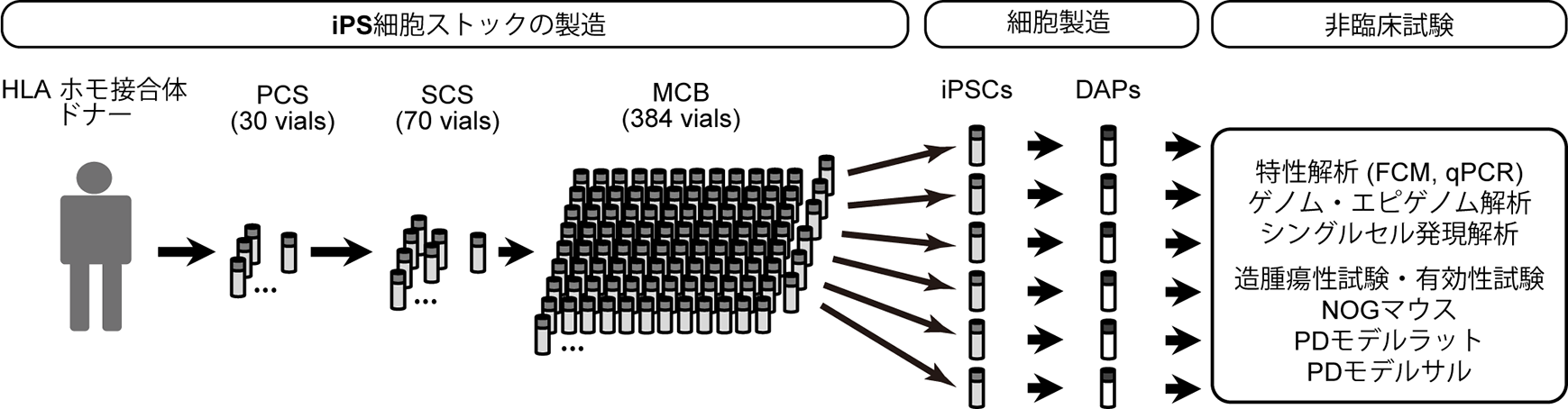
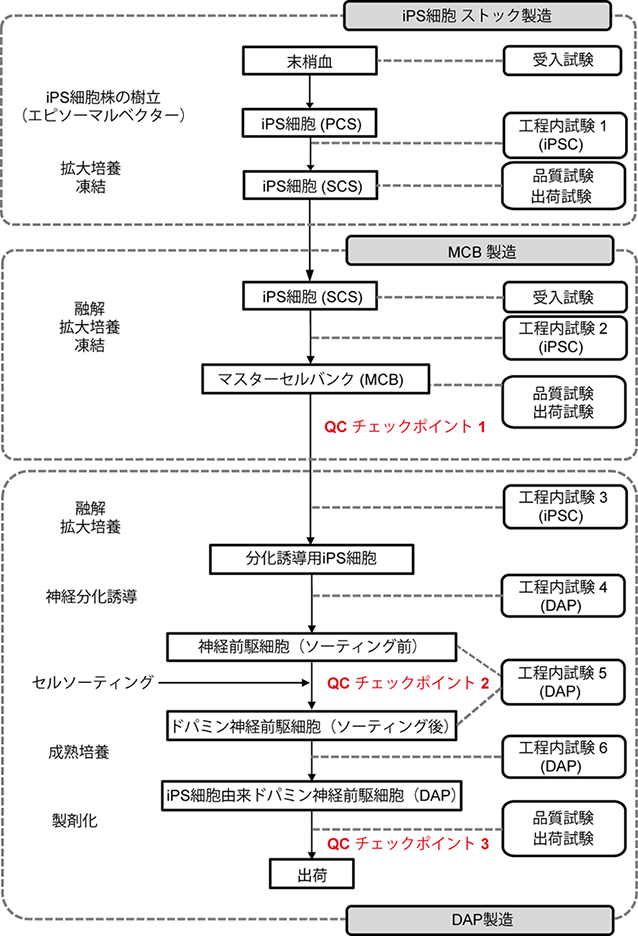
1)ヒトiPS細胞由来ドパミン神経前駆細胞(DAP)の製造工程(図2)
まず臨床用の細胞製剤を製造する工程を確立しました。原料としてHLAホモ接合体ボランティアドナーから京都大学iPS細胞研究所で樹立されたiPS細胞ストックを使用し、数百本のマスターセルバンク(MCB)注2)を作製しました。患者さんの治療ではMCBのバイアル1本を融解しDAPを分化誘導して凍結せずにそのまま移植に使用する計画であり、非臨床試験でも同様の方法で25本のMCBを融解・分化誘導して製造工程の再現性を確認しました。分化誘導の方法は、これまでに開発した研究用の分化誘導方法をもとに、試薬や抗体、セルソーターを臨床使用可能なものに変更しました。
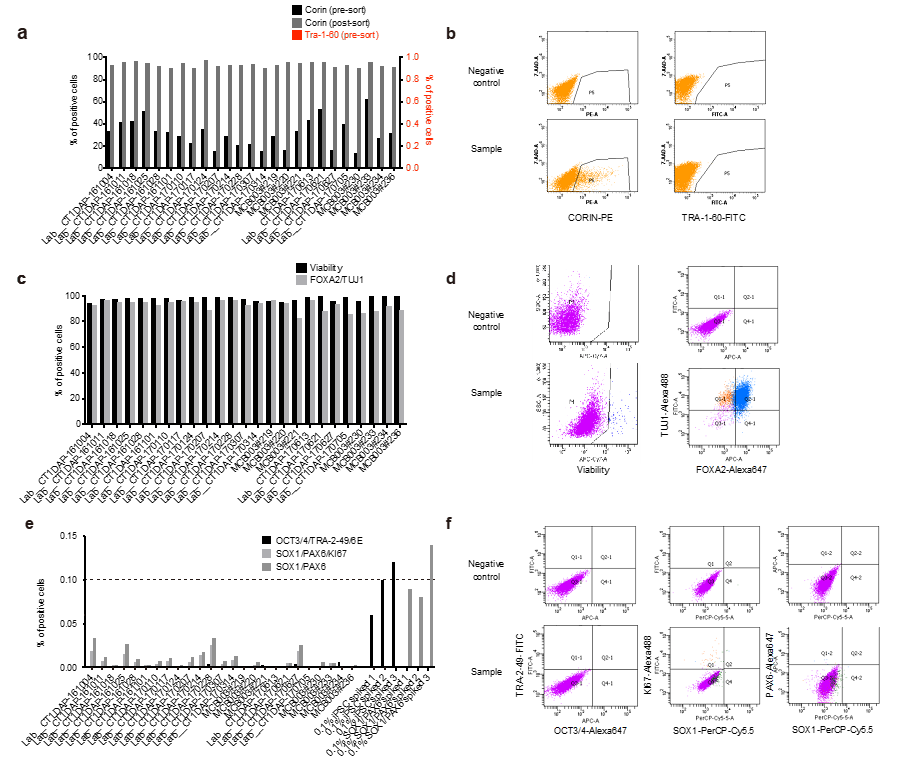
2)iPS細胞および最終製品の特性評価(図3)
分化誘導工程中の品質評価として3点のチェックポイント(iPS細胞、セルソーティング前後、最終製品)を設定しました。まずiPS細胞(MCB003)の品質評価として、コロニー形態やTRA-1-60、TRA-2-49、SSEA-4といった未分化細胞マーカーの確認、無菌性の確認を行いました。DAPは25回の分化誘導を行い、分化誘導12日目のセルソーティング前後で分化マーカー(CORIN)・未分化マーカー(TRA-1-60)の発現がそれぞれ10%以上、0.1%未満であることを確認しました。最終製品の品質管理として、分化誘導26日目において、DAP(FOXA2+TUJ1+)が主体(80%以上)であること、未分化な細胞(未分化iPS細胞:OCT3/4、TRA-2-49、LIN28、未分化な神経幹細胞:SOX1+PAX6+細胞)を含まないことをフローサイトメトリーや定量的PCRで確認しました。さらに、DAPが機能的な成熟ドパミン神経細胞へ分化することを、培地に放出されるドパミン量の測定や自発的な活動電位の電気生理学的解析で確認しました。
3)ゲノム・エピゲノム解析、シングルセル解析(図4)
細胞製剤のゲノム・エピゲノムの変異は移植後の細胞の挙動に影響する可能性があるため、製造工程中のゲノム・エピゲノムの安定性を評価しました。分化誘導を6回行い、それぞれのiPS細胞、分化誘導12日目及び26日目のサンプルで全ゲノム解析(whole genome sequencing:WGS)及びエクソーム解析(whole exome sequencing:WES)を行い、iPS細胞を樹立した末梢血の細胞と比較しました。
その結果、ゲノム解析ではがん関連遺伝子の変異は検出されず、73遺伝子のメチル化解析では悪性脳腫瘍と比較してメチル化レベルは低く、胎児組織や正常細胞と同等レベルであることを確認しました。
細胞製造工程の再現性を確認するために、6回の分化誘導で製造された細胞のシングルセル発現解析を行いました。その結果6回の分化誘導で製造された細胞集団は同じような分布を示し、ドパミン神経分化に関する遺伝子発現は6回の製造で同様であることを確認しました。
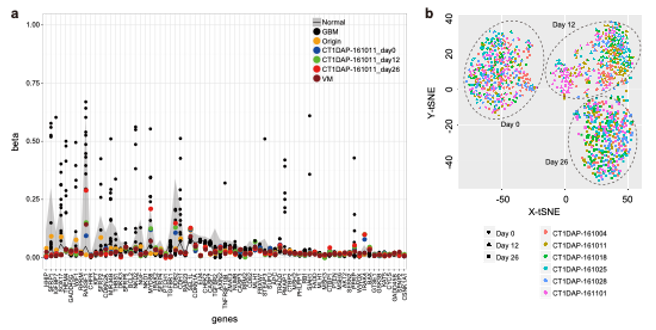
CT1-DAP:ドパミン神経前駆細胞、VM:胎児中脳腹側組織
4)一般毒性および造腫瘍性試験の結果(図5)
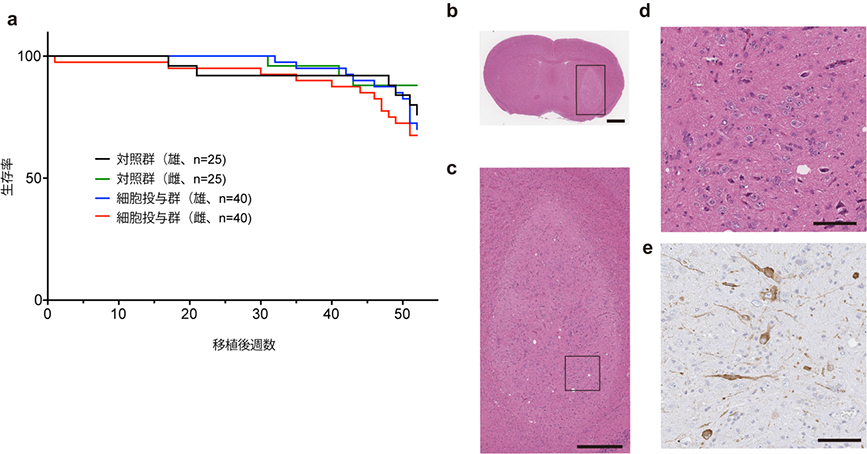
ゲノム・エピゲノム解析に使用した細胞と同じ細胞を用いて、GLP施設注3)において一般毒性・体内分布及び造腫瘍性試験を実施しました。医薬品医療機器総合機構(PMDA)との議論の結果、観察期間は免疫不全マウス(NOGマウス)の寿命期間、最低10匹は組織学的評価を行う計画とし、80匹(対照群:50匹)に投与を行いました。移植後52週間の時点で寿命により対照群の雄マウスが19匹に減少したため観察を終了し、組織学的評価を行いました。ヘマトキシリン・エオジン(H-E)染色で組織学的悪性所見や増殖像は認められず、ドパミン神経細胞の生着が確認されました。これらの結果から、細胞製剤の造腫瘍性は無いものと考えられました。また、移植を受けた動物に細胞移植が原因と思われる異常所見は認められず、ヒト細胞は脳内のみに存在し他臓器への転移は認められませんでした。
未分化iPS細胞の混入を検出するため、NOGマウス皮下にマトリゲル包埋した最終製品とスパイクコントロールとして0.001~10%の未分化iPS細胞を最終製品に添加した細胞を移植しました。陽性対照群であるHeLa細胞や他のiPS細胞株では皮下腫瘤を形成したのに対して、最終製品及びスパイクコントロールはいずれも皮下腫瘤を形成せず、製品への未分化iPS細胞は混入しておらず、もし混入したとしても腫瘍形成を生じないことが確認されました。
5)有効性試験の結果
有効性を確認するために、6-OHDA(6-ヒドロキシドパミン、6-hydroxydopamine)で片側のドパミン神経細胞を脱落させたPDモデルラットへ最終製品の移植を行いました。移植後16週間でメタンフェタミン投与下の異常回転運動は正常化し、線条体内にはドパミン神経細胞の生着と神経突起伸展が確認されました。
本研究の意義と今後の課題
本研究によって、ヒトiPS細胞由来ドパミン神経前駆細胞の安全性と有効性が確認されました。この結果に基づいてPMDA及び京都大学医学部附属病院治験審査委員会の承認を得て、京都大学医学部付属病院で医師主導治験(パーキンソン病に対するヒトiPS細胞由来ドパミン神経前駆細胞の細胞移植による安全性及び有効性を検討する医師主導治験、第I/II相)を開始しています。多能性幹細胞由来の細胞製剤の非臨床試験、特に造腫瘍性試験の計画やゲノム解析の是非についてはコンセンサスがなく、今回のような非臨床試験の結果を蓄積することで、試験の標準化への議論が進むことが期待されます。
論文名と著者
- 論文名
- “Pre-clinical study of induced pluripotent stem cell-derived dopaminergic progenitor cells for Parkinson’s disease.”
- ジャーナル名
- Nature Communications
- 著者
- Daisuke Doi1, Hiroaki Magotani1,2, Tetsuhiro Kikuchi1, Megumi Ikeda1,3, Satoe Hiramatsu1,3, Kenji Yoshida1,3, Naoki Amano4, Masaki Nomura4, Masafumi Umekage4, Asuka Morizane1, and Jun Takahashi1*
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA) 臨床応用研究部門
- 株式会社新日本科学 安全性研究所
- 大日本住友製薬株式会社 再生・細胞医薬神戸センター
- 京都大学iPS細胞研究所(CiRA)細胞調製施設(FiT)
*:責任著者
- DOI
- 10.1038/s41467-020-17165-w
本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実用化研究事業
用語説明
- 注1)ドパミン神経前駆細胞(DAP)
- 神経伝達物質としてドパミンを放出するドパミン神経細胞の前駆細胞。パーキンソン病モデル動物を用いた研究から、ドパミン神経前駆細胞を移植することによって脳内に成熟ドパミン神経細胞を効率的に生着させられることが明らかになっている。
- 注2)マスターセルバンク(MCB)
- 製造用の細胞を一定の培養条件下で増殖させ、複数のバイアルに分注したもの。原料となるiPS細胞を大量にストックすることで安定した品質の製品を得ることが可能となる。
- 注3)GLP(Good Laboratory Practice)
- 医薬品の開発のために行われる非臨床試験のデータ信頼性を確保するための基準。試験施設の設備・機器・手順などが安全かつ適切であることを保証する。
お問い合わせ先
本リリースに関すること
京都大学iPS細胞研究所(CiRA)研究支援部門
国際広報室 大内田美沙紀
TEL:075-366-7005 FAX:075-366-7034
E-mail:cira-pr“AT”cira.kyoto-u.ac.jp
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課
TEL:03-6870-2220
E-mail:saiseinw“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年8月6日
最終更新日 令和2年8月6日


