成果情報 ウイルスによる細胞のストレス応答抑制機構の解明―ウイルスタンパク質による神経保護治療の可能性を探る―
成果情報
理化学研究所
東京大学
日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター翻訳構造解析研究チームの伊藤拓宏チームリーダー、柏木一宏研究員、理研開拓研究本部岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員、七野悠一基礎科学特別研究員、東京大学生産技術研究所の池内与志穂准教授、大﨑達哉特任助教らの国際共同研究グループ※は、宿主細胞のストレス応答[1]を逃れて増殖するウイルスの分子機構を解明し、この分子機構を応用することで神経細胞の変性を抑制できることを示しました。
本研究成果は、細胞がウイルス感染を検知して翻訳を止める「ストレス応答経路」の解明や、ストレス応答経路が病態に深く関与している神経変性疾患[2]の治療法の開発につながるものと期待できます。
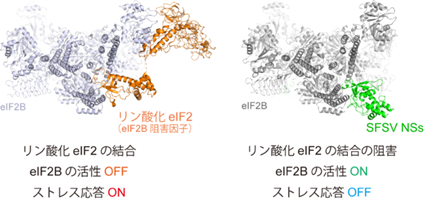
今回、国際共同研究グループは、シチリア型サシチョウバエ熱ウイルス(SFSV)[3]の「NSsタンパク質[4]」が、宿主細胞のストレス応答を抑制する機構を解明しました。宿主細胞のストレス応答は、リン酸化[5]された翻訳開始因子[6]「eIF2[6]」が他の翻訳開始因子「eIF2B[6]」に結合してその活性を阻害することで引き起こされます。SFSVのNSsタンパク質は、リン酸化eIF2がeIF2Bに結合する部位をふさぐようにeIF2Bに結合することで、宿主細胞のストレス応答を防いでいることが明らかになりました。また、NSsタンパク質はウイルス感染に限らず幅広いストレスに対する応答を抑制し、ストレスにさらされた神経細胞の変性を緩和する効果があることも分かりました。
本研究は、科学雑誌『Nature Communications』(2021年12月7日付:日本時間2021年12月7日)に掲載されました。
- ※国際共同研究グループ
-
- 理化学研究所
- 生命機能科学研究センター 翻訳構造解析研究チーム
- チームリーダー 伊藤 拓宏(いとう たくひろ)
- 研究員 柏木 一宏(かしわぎ かずひろ)
- 技師 坂本 恵香(さかもと あやこ)
- 技師 西本 まどか(にしもと まどか)
- 技師 髙橋 真梨(たかはし まり)
- 開拓研究本部 岩崎RNAシステム生化学研究室
- 主任研究員 岩崎 信太郎(いわさき しんたろう)
- 基礎科学特別研究員 七野 悠一(しちの ゆういち)
- テクニカルスタッフⅠ 水戸 麻理(みと まり)
- 東京大学 生産技術研究所
- 准教授 池内 与志穂(いけうち よしほ)
- 特任助教 大﨑 達哉 (おおさき たつや)
- ユストゥス・リービッヒ大学 ウイルス研究所(独国)
- 教授 フリーデマン・ウェーバー(Friedemann Weber)
- 研究支援
- 本研究は、理化学研究所運営費交付金(生命機能科学研究、組織横断連携プロジェクト「ライフサイエンスの横断的取組による超高齢社会課題解決への貢献」、独創的研究課題「動的構造生物学」、独創的研究課題「細胞内環境の生物学」、基礎科学特別研究員制度、奨励課題)で実施し、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)「プロテオスタシスの理解と革新的医療の創出」研究開発領域(研究開発総括:永田和宏)における研究開発課題「神経変性疾患におけるアグリゲーションと翻訳の陰陽(研究開発代表者:岩崎信太郎)」、同創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)「統合的構造解析に向けた高難度複合体の生産支援と高度化(研究開発代表者:白水美香子)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「複合体間の動的な相互作用による翻訳制御の構造基盤(研究代表者:伊藤拓宏)」、同若手研究「ストレス環境における翻訳開始因子eIF2Bの活性阻害機構の解明(研究代表者:柏木一宏)」、同若手研究(A)「翻訳開始因子パラログによる選択的翻訳の網羅的解析(研究代表者:岩崎信太郎)」、同挑戦的研究(萌芽)「重力による翻訳制御の網羅的解析(研究代表者:岩崎信太郎)」、同若手研究「翻訳開始因子eIF4A1とグルタミン代謝による協調的な発現制御機構(研究代表者:七野悠一)」、同学術変革領域研究(A)「非ドメイン型バイオポリマーの立体構造・相互作用解析(研究代表者:伊藤拓宏)」および「APEX-Ribo-Seq: 近傍標識による非典型局所翻訳の網羅解析(研究代表者:七野悠一)」、同学術変革領域研究(B)「新規Disome-Seq法: パラメトリックなリボソーム渋滞の網羅的探索(研究代表者:岩崎信太郎)」、同若手研究「脳・脊椎統合運動回路モデルの作製とALS発症メカニズムの解明(研究代表者:大﨑達哉)」、AMED次世代がん医療創生研究事業(P-CREATE)「MPS1を標的とした免疫チェックポイント阻害剤治療抵抗性を克服するための新規治療法の開発(研究代表者:北嶋俊輔)」武田科学振興財団生命科学研究助成「iPS免疫細胞と脳オルガノイド技術を用いた自己免疫性てんかんの病理解明(研究代表者:大﨑達哉)」、JSPS科学研究費補助金学術変革領域研究(B)「柔軟な神経らしさを作り出すパラメトリック翻訳制御の解明(研究代表者:池内与志穂)」、同挑戦的研究(開拓)「機能する培養ヒト神経回路組織の構築(研究代表者:池内与志穂)」、Beyond AI研究推進機構「人工脳組織を用いた脳機能解明(研究リーダー:池内与志穂)」による支援を受けて行われました。
背景
細胞に感染したウイルスは、細胞のタンパク質合成(翻訳)装置を利用して自身のタンパク質を合成し、増殖します。これに対して細胞側はウイルスによる乗っ取りを防ぐため、タンパク質合成を一時的に停止しようとします。このときに働く仕組みが、翻訳開始因子「eIF2」のリン酸化です。リン酸化されたeIF2は他の翻訳開始因子「eIF2B」の活性を阻害することで、翻訳の変化を引き起こします。通常、eIF2BはeIF2を活性化し翻訳を促進する機能を担いますが、リン酸化されたeIF2がeIF2Bに結合すると、eIF2Bの活性化機能は失われます。その結果として細胞内の活性型eIF2が枯渇するため、翻訳は全体的に抑制され、一方でストレスに対処するための別の因子が選択的に合成されるようになります。
細胞におけるeIF2のリン酸化を介したこのような応答は、酵母からヒトまでの全ての真核生物に共通の機構です。ウイルス感染時だけでなく、アミノ酸の欠乏や小胞体ストレス[7]などさまざまなストレス環境下で共通して誘導されることから、「統合的ストレス応答(ISR)[8]」と呼ばれています。
一方、ウイルス側もこうした宿主細胞の応答を回避する多様な機構を進化させています。2020年、シチリア型サシチョウバエ熱ウイルス(SFSV)の非構造タンパク質の一つである「NSsタンパク質」が、宿主細胞のeIF2Bに結合することで宿主のストレス応答を抑制していることが報告されました注)。これは、ウイルスによるeIF2Bを標的としたストレス応答抑制機構の最初の報告例でしたが、具体的にどのような機構で抑制が行われているかについては未解明でした。
注)J. D. Wuerth et al., eIF2B as a target for viral evasion of PKR-mediated translation inhibition. mBio 11, e00976-20 (2020).
研究手法と成果
国際共同研究グループは、クライオ電子顕微鏡法[9]を用いて、宿主細胞のeIF2BとSFSV NSsタンパク質(以下NSsタンパク質)の複合体の構造を解析しました。その結果、NSsタンパク質のeIF2Bへの結合部位は、リン酸化eIF2が結合する部位と部分的に重なっていることが判明しました(図1A、B)。これは、リン酸化eIF2とNSsタンパク質はeIF2Bに同時に結合できないことを示しています。すなわち、NSsタンパク質はリン酸化eIF2がeIF2Bに結合するのを邪魔し、eIF2Bの活性阻害によるストレス応答を防いでいる可能性が示されました。実際に生化学的手法により、NSsタンパク質がリン酸化eIF2によるeIF2Bの活性阻害を抑制していることを確認しました(図1C)。
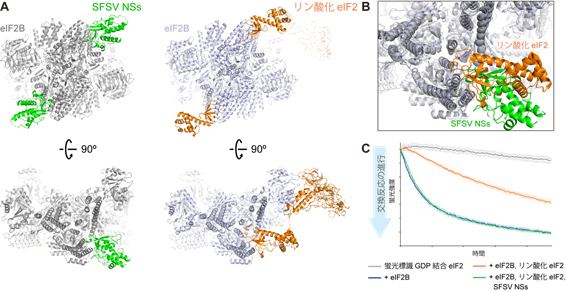
- eIF2B上で、部分的に重なった部位に結合するSFSV NSsタンパク質(左)とリン酸化eIF2(右)。
- Aの結合部位(下段)を拡大し、両者の構造を重ね合わせたもの。
- リン酸化eIF2やSFSV NSsタンパク質の存在下での、eIF2BのeIF2活性化能。eIF2Bは、eIF2に結合したGDP(グアノシン二リン酸)をGTP(グアノシン三リン酸)へ交換することで、eIF2を活性化する。この実験では、蛍光標識したGDPが結合したeIF2をeIF2Bと反応させており、蛍光強度が低下するほど、eIF2Bによる交換反応が進行していることを意味する。
宿主細胞の統合的ストレス応答(ISR)経路において、eIF2Bはストレスの種類に関係なく共通して阻害されるため、eIF2Bを標的とするNSsタンパク質はウイルス感染時に限らず、さまざまなストレスに対する応答を抑制する能力があると考えられます。実際に、薬剤によって小胞体ストレスを引き起こしたところ、NSsタンパク質を発現している細胞では、翻訳の全体的抑制とストレス応答因子の選択的合成という、ISRの二つの主要な効果がともに抑制されることが確認されました。
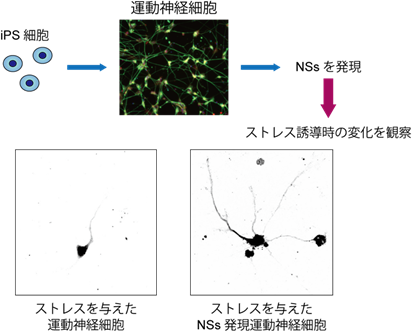
また、何らかの理由により、神経細胞でISRが長期的に活性化されてしまうと、神経細胞死の一因となることが多くの神経変性疾患で報告されています。そのため、NSsタンパク質によるISRの抑制機構を応用すれば、こうした疾患において神経変性を抑制する治療法の開発が可能になると考えられます。そこで、ラット海馬[10]神経細胞やヒトiPS細胞[11]から作製された運動神経細胞でNSsタンパク質を発現させ、小胞体ストレスに対する影響を調べたところ、どちらの神経細胞でも神経突起[12]の変性などの影響が緩和されることが分かりました(図2)。
今後の期待
SFSVのNSsタンパク質は、宿主細胞のISRを強力に抑制するため、ISRやその疾患との関係の研究における実験的ツールとして有用であると考えられます。これまでISRの阻害剤としては、ISRIB[13]と呼ばれる低分子が広く利用されていますが、この分子による阻害効果は高濃度でも部分的であり、ストレス応答を完全に無効化することは不可能でした。ストレス応答をほぼ完全に無効化できるNSsタンパク質の利用によって、ISRに対するより正しい理解がもたらされると期待できます。
また、今回の研究ではストレス環境下の培養神経細胞において、NSsタンパク質がヒト神経細胞の変性を緩和する効果を観察できました。今後は、生体内の神経細胞においても同様に変性を防止する効果が示されるのか検証を行う必要があります。ISRの長期的活性化は、多くの神経変性疾患に共通して見られる異常であることから、NSsタンパク質によるISRの抑制は、広範囲の神経疾患に対する新たな治療戦略となると期待できます。
論文情報
- タイトル
- eIF2B-capturing viral protein NSs suppresses the integrated stress response
- 著者名
- Kazuhiro Kashiwagi, Yuichi Shichino, Tatsuya Osaki, Ayako Sakamoto, Madoka Nishimoto, Mari Takahashi, Mari Mito, Friedemann Weber, Yoshiho Ikeuchi, Shintaro Iwasaki & Takuhiro Ito
- 雑誌
- Nature Communications
- DOI
- 10.1038/s41467-021-27337-x
補足説明
- [1]ストレス応答
- 熱ショック、活性酸素、高浸透圧、紫外線、放射線、ウイルス感染など、環境からのストレスに対して細胞が示す反応。細胞の恒常性維持に働くほか、細胞死を誘導する場合もある。
- [2]神経変性疾患
- 神経細胞の変性・脱落を伴う病気の総称。異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起こると考えられている。前頭側頭葉変性症(FTLD)、アルツハイマー型認知症、パーキンソン病、プリオン病、筋萎縮性側索硬化症(ALS)などが知られている。
- [3]シチリア型サシチョウバエ熱ウイルス(SFSV)
- 地中海地域で見られる、パパタシ熱と呼ばれるインフルエンザ様症状を伴う疾患の原因となるウイルスの一種。サシチョウバエと呼ばれる吸血性のハエによって媒介される。SFSVはSandfly Fever Sicilian Virusの略。
- [4]NSsタンパク質
- ウイルスゲノムがコードするタンパク質は、ウイルスの殻などを構成する構造タンパク質(structural protein)と、ウイルスの増殖のために用いられる非構造タンパク質(nonstructural protein)に大別される。NSsタンパク質はSFSVのゲノムにコードされている非構造タンパク質の一つ。SFSVのゲノムのSセグメントと呼ばれる領域にコードされているため、NSsと名付けられている。
- [5]リン酸化
- タンパク質を構成するアミノ酸のうち、セリン、スレオニン、チロシン残基の持つ水酸基(-OH)に、リン酸基が付加される反応をタンパク質のリン酸化と呼ぶ。リン酸基の付加は、しばしばタンパク質の構造変化を招き、細胞内シグナル伝達の制御などに重要な役割を果たす。
- [6]翻訳開始因子、eIF2、eIF2B
- 「翻訳開始因子」は、細胞内でタンパク質合成(翻訳)を行うリボソームが合成を開始する際に、協調的に働くタンパク質の総称。真核生物の翻訳開始因子は、真核生物型開始因子(eukaryotic initiation factor: eIF)と呼ばれる。その一つである「eIF2」はGタンパク質で、GTPが結合すると翻訳に参加できる。「eIF2B」は、eIF2をGDP結合型(不活性型)からGTP結合型(活性型)へと変換する作用を持つ。
- [7]小胞体ストレス
- 細胞小器官の一つである小胞体では、膜タンパク質や分泌タンパク質の折り畳みなどが行われる。正しく折り畳まれなかったタンパク質などの異常なタンパク質が小胞体に蓄積した状態を小胞体ストレスと呼ぶ。
- [8]統合的ストレス応答(ISR)
- ストレスにさらされた細胞は、タンパク質の翻訳を全体的に抑制することにより細胞への負荷を減らし、その一方で一部のタンパク質の翻訳を選択的に誘導し、ストレスに適応するための遺伝子の発現を誘導する。この一連の翻訳制御は、各種のストレスに対応する複数種のeIF2リン酸化酵素の活性化から始まり、eIF2のリン酸化に集約されているため、統合的ストレス応答(integrated stress response: ISR)と呼ばれている。
- [9]クライオ電子顕微鏡法
- 生体試料を液体エタンにより急速凍結し、ガラス状の氷に閉じ込め、透過型電子顕微鏡を用いて直接観察する手法。画像処理技術を駆使することで、リボソームなどの超分子複合体やタンパク質複合体の三次元立体構造を得られる。
- [10]海馬
- 記憶の形成や学習に重要な役割を果たす大脳の部位。
- [11]iPS細胞
- 皮膚などから採取した細胞にいくつかの遺伝子を導入することで人工的に作製された、多くの種類の細胞へ分化する能力と未分化状態で増殖する能力を持つ細胞。
- [12]神経突起
- 神経細胞から伸びる細長い突起で、シナプスを介して他の細胞との情報のやり取りを行う。
- [13]ISRIB
- カリフォルニア大学サンフランシスコ校のWalter教授らのグループが、統合的ストレス応答(ISR)を抑制する低分子化合物のスクリーニングにより単離した分子量451の小分子。筋萎縮性側索硬化症(ALS)などの神経疾患に対する治療薬として期待されている。Integrated Stress Response InhiBitorの略。
発表者・機関窓口
発表者
理化学研究所
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(いとう たくひろ)
研究員 柏木 一宏(かしわぎ かずひろ)
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
基礎科学特別研究員 七野 悠一(しちの ゆういち)
東京大学 生産技術研究所
准教授 内 与志穂(いけうち よしほ)
特任助教 大﨑 達哉(おおさき たつや)
TEL:03-5452-6330 FAX:03-5452-6331
E-mail:yikeuchi[at]iis.u-tokyo.ac.jp(池内)
生命機能科学研究センターに関する問い合わせ
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
E-mail:ayamagishi[at]riken.jp
機関窓口
*今般の新型コロナウイルス感染症対策として、理化学研究所では在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp
東京大学 生産技術研究所 広報室
TEL:03-5452-6738 FAX:03-5452-6421
E-mail:pro[at]iis.u-tokyo.ac.jp
AMED事業に関する問い合わせ
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
〒100-0004 東京都千代田区大手町1-7-1 読売新聞ビル21階
TEL:03-6870-2224
E-mail:kenkyuk-ask[at]amed.go.jp
※E-mailは上記アドレス[at]の部分を@に置き換えてください。
掲載日 令和4年2月7日
最終更新日 令和4年2月7日


