成果情報 シグナル伝達の「偏り」を生み出すリン酸化機構の解明―副作用を切り分けたGPCR作動薬の開発に貢献―
成果情報
東北大学大学院薬学研究科
理化学研究所
日本医療研究開発機構
発表のポイント
- 薬剤の主要な作用標的であるGタンパク質共役型受容体(GPCR、注1)の機能を調節する因子のGPCRキナーゼ(GRK、注2)について、その活性制御機構を明らかにしました。
- 降圧薬の標的として知られる1型アンジオテンシンII受容体(AT1受容体、注3)に関して、薬理作用の異なる作動薬が、別々のGRK選択性とβアレスチン(注4)機能を誘導することを見出しました。
- 本研究は、GPCRに作用する薬剤について、副作用が少なく安全性の高い創薬開発戦略を提示します。
概要
細胞膜に存在するGPCRと呼ばれるタンパク質センサーは、薬剤の主要な標的として知られています。通常のGPCR作動薬は、シグナル伝達因子である三量体Gタンパク質(以下Gタンパク質、注5)とβアレスチンの双方を作動させます。一方、特定のシグナル因子の機能のみを誘導する「バイアス型作動薬(注6)」は、副作用を低減させた理想的な薬剤になると期待されます。このような薬理作用のバランスは、薬剤が結合したGPCRの「かたち」そのものに大きく依存しているとこれまで考えられてきました。
今回、東北大学大学院薬学研究科の川上耕季研究員・井上飛鳥准教授らのグループは、理化学研究所開拓研究本部の柳川正隆研究員・佐甲靖志主任研究員らのグループとの共同研究により、βアレスチンの機能を制御する主要な因子であるGPCRキナーゼ(GRK)に着目した解析を実施し、GRKがGタンパク質の一種であるGqにより機能制御される新たな分子機構を解明しました。本研究成果を通じて、Gタンパク質とβアレスチンによる2つのシグナルバランスは、細胞膜に存在するGPCRの「かたち」だけでなく、細胞内に存在するGタンパク質の活性レベルがGPCRとGRKの「居場所」を変えることでβアレスチンの機能を調節するという、シグナルバランス制御機構の新たな概念を提唱しました。
本研究の成果は、日本時間2022年1月25日に科学雑誌Nature Communications誌の電子版に掲載されました。
研究の背景
Gタンパク質共役型受容体(GPCR)は膜タンパク質です。ヒトには約800種類存在し、このうち薬剤の標的となりやすいものが約300種類存在します。GPCRは細胞外の情報を細胞内に伝達するセンサーとしての役割があり、多岐にわたる生理現象に関わることが知られています。
GPCRは細胞外から生体内リガンドや薬物が結合することで、タンパク質の立体構造が変化します。構造変化したGPCRに対して、細胞内のタンパク質である三量体Gタンパク質(以下、Gタンパク質)とβアレスチンがそれぞれ異なるタイミングで結合します。Gタンパク質を構成するサブユニットのうち、GαはGPCRとの結合に主要な役割を担います。GPCRと結合したGタンパク質はGTP結合型となり、シグナル実行因子であるエフェクタータンパク質(注7)の活性を制御します。Gαは16種類存在し、それぞれのGαが特定のGPCRとエフェクタータンパク質に結合することで、GPCRごとのシグナル伝達パターンを決めます。一方、βアレスチンは2種類しか存在しないにも関わらず、多様なシグナル伝達因子の活性化を誘導できます。この機構として、βアレスチンはリン酸化バーコードと呼ばれるGPCRのリン酸化パターンを認識して、バーコードに応じた構造状態を形成します。βアレスチンの構造に応じて異なるシグナル因子が結合し、シグナル伝達パターンが変化することが知られています。このバーコードを形成するリン酸化酵素として、GPCRキナーゼ(GRK)が存在します。本研究者らは以前の研究で、Gαに関して、そのシグナル活性化検出系の開発(Inoue et al., Nat Methods 2012)と、この基盤技術をもとにしたGα選択機構の解明(Inoue et al., Cell 2019)に取り組んできました。一方で、βアレスチンの多様性やこれを生み出すGRK選択性機構については、解析手法の不足等により不明な点が多く残されていました。
上記の2つのシグナル因子(Gタンパク質とβアレスチン)は、従来は独立して機能しているものとして考えられていました。また、一方のシグナルが薬の主作用に、もう一方のシグナルが副作用に関わる例が知られています。この作用の違いから、シグナル因子のバランスを変えたバイアス型作動薬は、副作用を低減させた安全性の高い薬となることが期待されています。このバイアス型作動薬の創製においては、どちらか一方のシグナル因子のみを活性化可能なGPCRの構造状態を作り出すための構造学的な理解が重要であると考えられており精力的に研究が進められています。その一方で本研究者らは、GPCRの構造だけでは理解できないような、細胞内のシグナル因子が司るシグナルバランス制御機構があるのではないかと考え、本研究を開始しました。
研究手法と成果
1.発光センサーを用いた培養細胞におけるGRK選択機構とβアレスチン機能解析
本研究では、1型アンジオテンシンII受容体(AT1受容体)とその作動薬をモデルとして、GRKの選択機構を調べました。この解析に際し、GPCRシグナル研究に汎用され、遺伝子導入を簡便に実施できるHEK293細胞をモデル培養細胞株として利用しました。まず、4種類の主要GRKサブタイプ(GRK2、GRK3、GRK5、GRK6)をCRISPR/Cas9法(注8)により欠損させたGRK欠損細胞を作製しました。次に、NanoBiTシステムを利用して、AT1受容体とβアレスチンの相互作用を発光シグナルとしてリアルタイムに検出できるセンサーを構築しました。これら2つの研究ツールを組み合わせることで、これまでは困難であった、どのGRKサブタイプを介してリン酸化されたAT1受容体にβアレスチンが結合するかという過程を測定できるようになりました。本実験系を用いた解析から、生体内リガンドであるアンジオテンシンIIと臨床試験薬であるTRV027(注9)との間では、異なるGRKサブタイプがAT1受容体のリン酸化に寄与することがわかりました(図1)。さらにβアレスチンの構造・機能解析(AT1受容体に対するβアレスチンの結合様式、AT1受容体エンドサイトーシス、シグナル活性化)から、アンジオテンシンIIとTRV027との間では、AT1受容体に結合したβアレスチンの構造的かつ機能的な違いが存在することがわかりました。
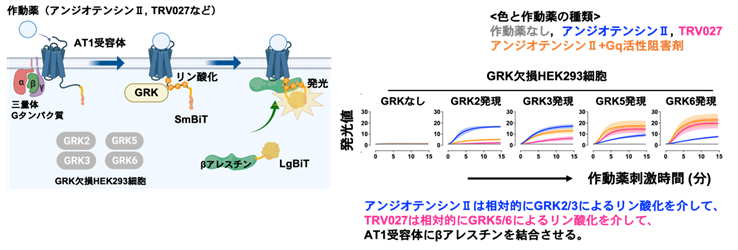
(右図)内在性リガンドであるアンジオテンシンII刺激(青)と、バイアス型作動薬の一つであるTRV027刺激(マゼンタ)、Gq阻害剤を前処置+アンジオテンシンII刺激(オレンジ)の3条件でβアレスチン結合のAT1受容体への結合を測定した。その結果、アンジオテンシンII刺激時には、相対的にGRK2やGRK3を介しAT1受容体にβアレスチンが結合する一方で、TRV027刺激時では、相対的にGRK5やGRK6を介した作用が強いことがわかった。興味深いことに、Gq阻害剤存在下のアンジオテンシンII刺激時では、TRV027と同様のGRK選択性(GRK5やGRK6が相対的に強い)が生じた。これまではGPCRの構造に応じて結合するGRKサブタイプが変わると考えられてきたが、Gタンパク質のシグナル活性がGRKサブタイプの選択性に重要であることが初めて明らかとなった。
2.細胞内一分子イメージングによるGPCRとGRKの相互作用解析
GPCRと様々なシグナル因子の相互作用は形質膜(注10)で生じます。本研究者らの過去の細胞内一分子イメージング解析(注11)から、活性化したGPCRは約100nmの微小な膜ドメイン(注12)に集まって動きを止めることがわかっていました(Yanagawa et al., Sci. Signal. 2018, 柳川・佐甲 生物物理 2021)。もし、GRKがGPCRと同じ膜ドメインに集まれば、膜ドメイン内での両分子の密度が上昇し、高効率にリン酸化が引き起こされると予想されます。一方で、GRKがGPCRと異なる膜領域にいると、出会う機会が減ってリン酸化の効率が下がります。これまで、生きた細胞でGPCRとGRKの「居場所」を一分子レベルで同時に観察した例はありませんでした。本研究では、AT1受容体とGRK2/GRK5の二色同時一分子イメージングを行い、GPCRとGRKが出会う頻度・出会った後に一緒にいる時間(共局在時間)・場所を解析しました(図2)。
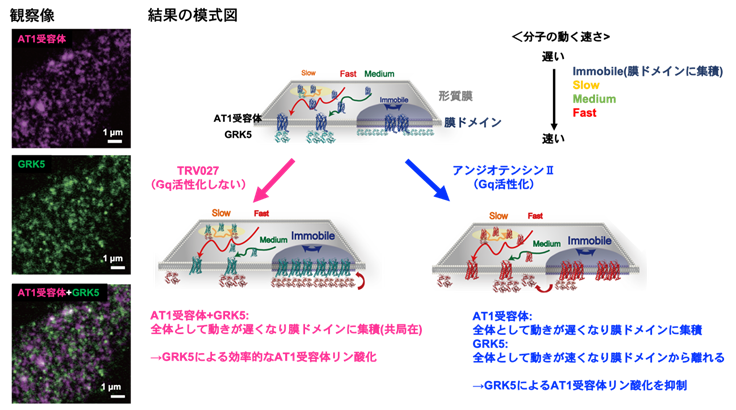
(右図)一連の解析から推測された形質膜上におけるAT1受容体とGRKの挙動変化のモデル図。AT1受容体タンパク質分子とGRK5タンパク質分子を速さの異なる4つの状態(Immobile、Slow、Medium、Fast)に分けて解析を行った。Gqが活性化されないTRV027刺激下では、AT1受容体とGRK5の両分子において膜ドメイン外を主に単量体として単純拡散する状態(Medium、Fast)が減少し、膜ドメイン内で多量体を形成して制限拡散する状態(Immobile、Slow)が増加した。2分子間の共局在解析から、同条件下でAT1受容体とGRK5が同じ膜ドメインに集積することが明らかになった。したがって、両分子の局所密度を上げることで効率的なAT1受容体のリン酸化が実現していると考えられる。一方、Gqが活性化されるアンジオテンシンII刺激下では、膜ドメインにAT1受容体が集積する一方で、GRK5は単純拡散する状態の割合が上昇した。AT1受容体とGRK5が空間的に隔離されることで両者の出会いの頻度が低下し、AT1受容体のリン酸化効率が低下していることが示唆された。
全反射蛍光顕微鏡を用いて、異なる蛍光色素で標識した形質膜中のAT1受容体とGRK分子の輝点を観察し、AT1受容体・GRK分子それぞれの動きと2分子間の相互作用を定量しました。動きの状態を統計的に解析したところ、いずれの分子も4つのグループに分類されることが示唆されました。このうち最も動きの遅いグループ(Immobile)が、上記の膜ドメインに集積した分子に相当します。まず、薬刺激前の細胞を観察したところ、不活性状態のAT1受容体とGRK5があらかじめ同じ膜ドメインに集積している様子が観察されました。Gqとβアレスチンの両方を活性化するアンジオテンシンIIで刺激をした細胞では、不活性状態と比べて両分子が出会う頻度が下がりました。一方、βアレスチンのみを活性化するTRV027で刺激をすると出会いの頻度は下がらず、共局在時間が伸びることが分かりました。アンジオテンシンIIで刺激した細胞では、AT1受容体が膜ドメインに集積するのに対して、GRK5は膜ドメイン外を速く拡散する分子の割合が増加しました。一方、GRK2はアンジオテンシンII刺激時にのみ、AT1受容体と共に膜ドメインに集積し、共局在時間が伸びる傾向を示しました。以上の結果は、Gqの活性化が、GRKの形質膜上の「居場所」を変えることでGRKのサブタイプ選択性に重要な役割を果たすことを示唆するものでした。
3.発光センサーを用いた培養細胞におけるGRKシグナル複合体解析
GqによるGRK5/GRK6の制御機構を調べるために、対象分子であるAT1受容体、GRK、Gqについて、NanoBiTスプリットルシフェラーゼ(注13)による二者間相互作用解析、さらにNanoBiTスプリットルシフェラーゼと蛍光タンパク質を組み合わせたNanoBiT-BRET法による三分子の相互作用を測定しました。その結果、不活性状態のAT1受容体がGqおよびGRK5/GRK6と細胞膜上で3者複合体を形成していることがわかりました。アンジオテンシンII刺激によりGqが活性化すると3者複合体が解消し、GRK5/6に対する選択性が下がることが示唆されました。一方、Gqを活性化しないTRV027刺激時には3者複合体は維持され、GRK5/6によりAT1受容体がリン酸化されます。このことは、これまでに知られていなかった新たなシグナル分子複合体による、GRKの機能制御の存在を示しています(図3)。
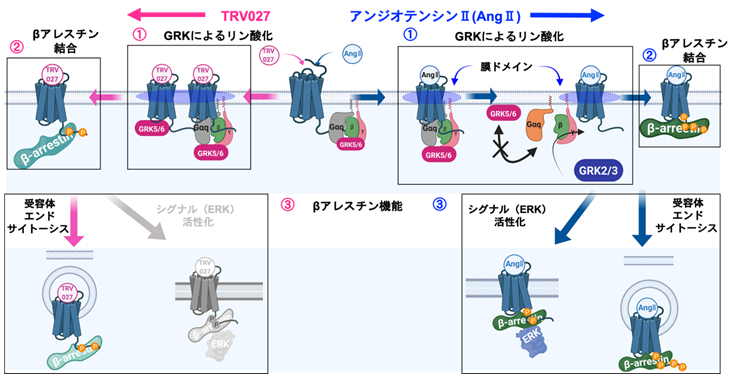
①GRKサブタイプ選択性と分子機構
アンジオテンシンII(Gq活性有り)刺激時には、主にGRK2やGRK3を介してAT1受容体にβアレスチンを呼び寄せる一方で、TRV027(Gq活性無し)刺激時ではGRK5やGRK6が使われることがわかった(図1参照)。分子レベルではAT1受容体とGRKの形質膜上での動態が重要であり(図2参照)、アンジオテンシンII刺激時には、膜ドメインからGRK5が排除されることで、GRK5によるAT1受容体リン酸化が生じにくくなるという機構が明らかとなった。発光センサーの実験では、AT1受容体とGqタンパク質およびGRK5の3分子が複合体を形成していることが明らかとなり、このシグナル複合体がGRK選択性に寄与していることが示唆された。
②βアレスチンのAT1受容体に対する結合様式の差異
異なるGRKサブタイプによりAT1受容体がリン酸化される結果として、AT1受容体へのβアレスチンの結合様式が異なることがわかった。アンジオテンシンII刺激時には、βアレスチンがAT1受容体の膜貫通コア領域と細胞内C末端ループの2箇所で結合する一方、TRV027刺激時においては、βアレスチンがAT1受容体のコアには結合せず、C末端ループのみで結合することを見出した。
③βアレスチンの機能差
アンジオテンシンIIやTRV027刺激時のAT1受容体リン酸化に関与するGRKサブタイプの違い(①)、AT1受容体に結合するβアレスチンの結合様式の違い(②)の結果として、βアレスチンの機能差が生じることがわかった。アンジオテンシンII刺激時には、βアレスチンを介したAT1受容体のエンドサイトーシス(細胞内取り込み)やMAPキナーゼの一種のERK活性化の両方を誘導する一方で、TRV027刺激時では、AT1受容体のエンドサイトーシスのみが生じることがわかった。
今後の展望
本研究により、βアレスチン機能を制御するGRKの活性制御機構が明らかとなりました。また、一方のシグナル因子(Gタンパク質)の活性化が、もう一方のシグナル因子(βアレスチン)を制御することで、全体のシグナルバランスが調節されるという、シグナルバイアス調節機構の存在が同時に明らかとなりました。今回の発見は、GPCRの構造の理解に加えて、細胞内シグナル活性化の理解を組み合わせることが、バイアス型作動薬創製に重要であることを示しており、今後のバイアス型作動薬開発に対して、さらなる理解と加速的な創製につながることが期待されます。
研究支援
本研究は、日本学術振興会(JSPS)の科学研究費助成事業(17K08264、20K05760、19J11256、20J20669、21H04791、21H05113、JPJSBP120213501、JPJSBP120218801)や国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業(BINDS)(JP20am0101095)、革新的先端研究開発支援事業ソロタイプ(PRIME)(JP19gm5910013)、革新的先端研究開発支援事業インキュベートタイプ(LEAP)(JP20gm0010004)、国立研究開発法人科学技術振興機構(JST)の戦略的創造研究推進事業さきがけ(JPMJPR1331、JPMJPR20EF)およびムーンショット型研究開発事業(JPMJMS2023)、第一三共生命科学研究振興財団、上原記念生命科学財団など多くの支援を受けて行われました。
用語説明
- (注1)Gタンパク質共役(きょうやく)型受容体(GPCR)
- 7回細胞膜を貫通する特徴的な構造を有する細胞膜受容体の一種である。ヒトにおいては約800種類存在しており、ホルモンなどの多様な細胞外の物質(リガンド)が結合することで、活性型へと構造変化をして、細胞内のシグナル因子と結合することで情報伝達を誘導する。
- (注2)GPCRキナーゼ(GRK)
- 細胞質に存在し、活性型構造のGPCRに結合して、そのセリン・スレオニン残基をリン酸化する酵素である。4種類のGRKサブタイプ(GRK2、GRK3、GRK5、GRK6)が全身に広く発現しており、これらがGPCRのセリン・スレオニン残基に対して様々なパターンでリン酸基を付与すると想定されている。
- (注3)1型アンジオテンシンII受容体(AT1受容体)
- アンジオテンシンIIを認識するGPCR。アンジオテンシンIIが結合するとGqタンパク質を介して血圧上昇を誘導する一方で、βアレスチンを介して心臓の収縮を促進する。
- (注4)βアレスチン
- リン酸化GPCRに結合する細胞質の多機能タンパク質。三量体Gタンパク質と競合することでGタンパク質シグナルに拮抗する役割があるほか、GPCRのエンドサイトーシスやシグナル因子の足場としても機能する。
- (注5)三量体Gタンパク質
- Gα, Gβ, Gγの3つのサブユニットからなるタンパク質複合体であり、作動薬が結合したGPCRと結合すると構造変化を受け、GTP結合型GαとGβγに解離する。
- (注6)バイアス型作動薬
- 基準となる作動薬(通常は内因性リガンド)と比べて、特定のシグナルに偏り(バイアス)を持って活性化する作動薬。主作用に関連するシグナルを強く誘導する一方で、望まない副作用に関連するシグナルを誘導しないバイアス型作動薬は、より安全性の高い薬となることが期待される。
- (注7)エフェクタータンパク質
- 本文では活性化型(GTP結合型)Gαに結合するタンパク質を指す。Gαのサブタイプごとに結合するエフェクタータンパク質は異なる(例: Gαsはアデニル酸シクラーゼ、GαqはホスホリパーゼCβなど)。
- (注8)CRISPR/Cas9法
- 細菌の獲得免疫様機構を元に開発された、ゲノムDNA配列の改変(ゲノム編集) 技術(2020年のノーベル化学賞の対象)。
- (注9)TRV027
- βアレスチンバイアス型作動薬。AT1受容体に結合して体内のアンジオテンシンIIと競合し、Gq活性化を誘導しないことで降圧効果を示す一方、βアレスチンを介した心不全改善作用を有する。古典的なアンジオテンシン受容体遮断薬がβアレスチンも不活化して心機能が低下する副作用が生じるのに対して、TRV027は逆の作用を有することから副作用を発動しない望ましい薬と考えられている。
- (注10)形質膜
- 細胞膜のうち、細胞外と細胞内を仕切る膜を指す。
- (注11)一分子イメージング解析
- 標的タンパク質を蛍光標識し、顕微技術により一分子の解像度で標的タンパク質の動態を可視化する技術。本研究においては、異なる波長の蛍光標識と全反射照明蛍光顕微鏡を用いることで、形質膜上のAT1受容体とGRKの動態を同時に計測している。
- (注12)膜ドメイン
- 形質膜は多数の脂質分子から構成されているが、その組成は均一ではなく、粘性の高い領域と低い領域に分離している。特にコレステロールやスフィンゴ脂質に富む微小な膜領域は、細胞内シグナル伝達を高効率に行うホットスポットとして活用されていると考えられている。
- (注13)スプリットルシフェラーゼ
- 発光タンパク質(ルシフェラーゼ)を分割して別々のタンパク質に融合することで、タンパク質間の相互作用を発光変化により測定する手法。本研究では深海エビ由来のNanoLucルシフェラーゼをもとに作られたNanoBiTシステム(SmBiT=小断片とLgBiT=大断片から構成、Promega社が開発)を用いた。
論文情報】
- 論文タイトル
- Heterotrimeric Gq proteins act as a switch for GRK5/6 selectivity underlying β-arrestin transducer bias
- 著者
- Kouki Kawakami†, Masataka Yanagawa†, Suzune Hiratsuka, Misaki Yoshida, Yuki Ono, Michio Hiroshima, Masahiro Ueda, Junken Aoki, Yasushi Sako*, Asuka Inoue *(†:共同筆頭著者、*:共同責任著者)
- 雑誌名
- Nature Communications
- 掲載日時 電子版
- 2022 年1月25日(日本時間)
- DOI
- 10.1038/s41467-022-28056-7
お問い合わせ先
研究内容に関すること
東北大学大学院薬学研究科
准教授 井上飛鳥
Tel:022-795-6861
E-mail:iaska“AT”tohoku.ac.jp
報道に関すること
東北大学大学院薬学研究科総務係
Tel:022-795-6801
E-mail:ph-som“AT”grp.tohoku.ac.jp
理化学研究所広報室 報道担当
Email:ex-press“AT”riken.jp
AMED事業に関すること
日本医療研究開発機構(AMED)
シーズ開発・研究基盤事業部 革新的先端研究開発課
Tel:03-6870-2224
E-mail:kenkyuk-ask“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和4年2月21日
最終更新日 令和4年2月21日


