ヒトiPS細胞由来心筋細胞に関するレギュラトリーサイエンス研究
 ヒトiPS細胞由来心筋細胞を用いた試験法の開発と検証実験
ヒトiPS細胞由来心筋細胞を用いた試験法の開発と検証実験
臨床研究・治験基盤事業部/規制科学・臨床研究支援室
ヒトiPS細胞由来心筋細胞の創薬への応用に弾み
国立医薬品食品衛生研究所、日本安全性薬理研究会などは、薬剤で誘発される致死性不整脈の発生予測に関する大規模な検証実験を世界で初めて行いました。この研究で、ヒトiPS細胞由来心筋細胞が予測性の高い安全性評価法に活用できることが分かりました。今後、同細胞を用いた安全性評価法確立に向けレギュラトリーサイエンス(有効性と安全性の評価科学)研究が進展し、臨床試験の軽減など創薬ストラテジーに変革が起こることを期待しています。
取り組み
ヒトiPS細胞由来心筋細胞の創薬が重要になる背景
現在、医薬品開発では動物を用いた非臨床試験で安全性を確認した上でヒトによる臨床試験に進みます。しかし、動物とヒトでは種が異なるため有害反応が異なる場合があり、動物では問題がなくても、臨床段階でヒトに対する毒性が確認され、研究が中止になることも少なくありません。特に心臓に対する毒性(心毒性)は重大な副作用の一つで、致死性不整脈(torsadesdepointes=TdP)の病態を非臨床段階で高精度に予測することは、患者に対する安全性の担保並びに医薬品開発の成功確率を上げるために極めて重要です。創薬プロセスをより効率的で安全なものにするため、種の異なる動物ではなくヒトiPS細胞由来心筋細胞を用いて薬剤の安全性を予測する新しい評価法が注目されています。
ヒトiPS細胞を利用した 安全性試験導入のメリット
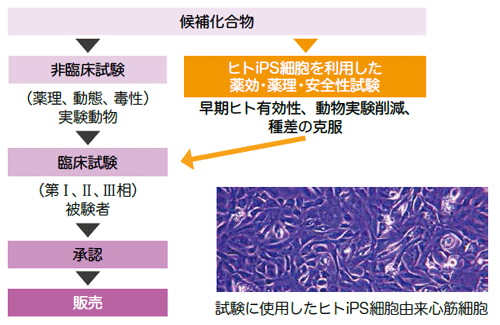
ヒトiPS細胞由来心筋細胞を使った安全性評価体制の構築
国立医薬品食品衛生研究所、日本安全性薬理研究会、製薬企業などからなる研究グループは、ヒトiPS細胞由来心筋細胞で薬剤の安全性を評価する研究に取り組んでいます。AMEDは、同研究がスムーズに進むよう支援し進捗管理を行っています。
成果例
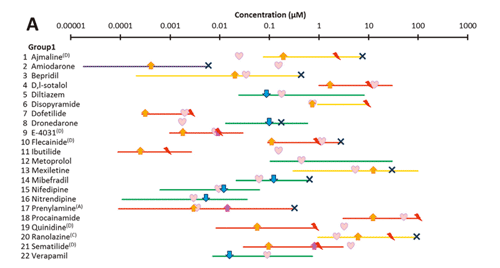
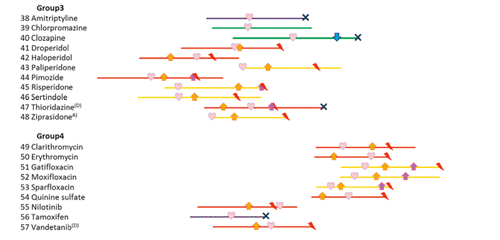
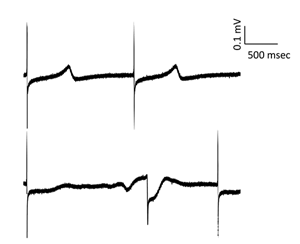
世界で初めてヒトiPS細胞由来心筋細胞を用いて、TdPの発生予測に関する大規模な検証実験を行いました。TdPリスクの異なる60種類の薬剤を用いて、心筋への応答性がどのように変化するか評価しリスク分類法を開発したところ、TdPリスクは実際の医療データと比較して非常に高い予測精度を得ることができました。つまり、ヒトiPS細胞由来心筋細胞を用いた試験法は、既存の評価系よりも精度良く、薬物の安全性を予測できることが明らかになりました。
TdPの発生予測に関する大規模検証実験の結果
展望
今後、ヒトiPS細胞由来心筋細胞を用いた医薬品安全性試験への利用が、飛躍的に進みそうです。また、今回の研究から得られた評価法が、創薬研究に適用可能なヒトiPS細胞由来心筋細胞の基準として使われ、国際標準にしていくことも目指しています。さらにこの安全性試験が、多剤併用や長期暴露による蓄積の影響などへ応用されることも期待されます。
最終更新日 平成30年10月5日


