2017年度 研究事業成果集 内転型けいれん性発声障害の治療用医療機器「チタンブリッジ®️」
 内転型けいれん性発声障害の治療用医療機器「チタンブリッジ®️」が実用化
内転型けいれん性発声障害の治療用医療機器「チタンブリッジ®️」が実用化
戦略推進部 難病研究課
医師主導治験を経て、「先駆け審査指定制度」(医療機器)承認第1号
チタンブリッジは、内転型けいれん性発声障害に対して実施される手術(甲状軟骨形成術2型)において使用されるチタン製の蝶番型プレートです。2015年6月より国内4施設で実施された医師主導治験の結果、有効性・安全性が確認され、国の先駆け審査指定制度医療機器第1号として審査が進められ、2017年12月に承認を得ました。
■チタンブリッジの実物

取り組み
内転型けいれん性発声障害は、原因不明の難治性疾患で、声帯が自分の意識とは関係なく収縮し、発声時に声帯が閉じてしまい、声が詰まったり途切れたりする病気です。日常生活において困難な状況が継続し、生活の質(QOL)が低下します。国内における患者数は約4900~9800人と推定されています。治療法としてはボツリヌス毒素の注射がありますが、効果の持続期間が3~4カ月と短く、繰り返しの投与が必要です。一方、声帯が締まりすぎないよう甲状軟骨(喉頭の軟骨)を縦に切開し、声帯と軟骨の付着部を軟骨ごと外側に広げて器具で固定する手術「甲状軟骨形成術2型」を行うと、半永久的な効果の持続が期待されます。「甲状軟骨形成術2型」は、京都大学の一色信彦名誉教授により2001年に開発され実施もされていましたが、手術に用いる器具は、医療機器として国の承認が得られていませんでした。そこで、熊本大学の讃岐徹治講師(現在は名古屋市立大学)らの研究グループがチタンブリッジの製品化を目的に、2015年6月より、熊本大学を含む国内4施設で、多施設共同医師主導治験を実施しました。
成果
医師主導治験では、内転型けいれん性発声障害の患者さん21人にチタンブリッジを使用した手術が実施され、声の障害の自覚の程度を評価する「VHI-10スコア」が大幅に改善しました。
チタンブリッジは、2016年2月に医療機器として初めて厚生労働省の先駆け審査指定制度の対象品目に選ばれました。さらに、医療上特に必要性の高い医療機器であるとして、2016年9月に希少疾病用医療機器の指定を受けました。先駆け審査指定制度の対象品目に選ばれることで、医薬品医療機器総合機構(PMDA)における相談や審査が優先され、通常では審査に1年程度かかるところ、ノーベルファーマ株式会社が製造販売を申請した半年後の2017年12月に承認を得ることができました。2015年度に先駆け審査指定制度が開始されて以来、医療機器初の承認品目となりました。
■チタンブリッジ甲状軟骨形成術2型
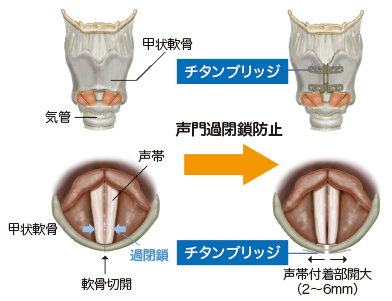
声帯と軟骨の付着部を広げて「チタンブリッジ」で固定する
展望
チタンブリッジは海外からも注目されており、海外での承認を得るため、米国、英国、韓国と国際共同治験を行う準備が進められています。「先駆け審査指定制度」の利用により、患者数が少ないために企業による開発が行われにくい難治性疾患分野の医薬品・医療機器開発において、AMEDが医師主導治験を積極的に支援することで、世界に先駆けて日本にて早期開発・実用化がなされ、日本の患者さんにいち早くその恩恵がもたらされることと、今後、国際共同治験実施によって海外にも展開されるケースが増えていくことが期待されます。
■国際共同治験も開始される

英国での国際共同治験実施のため英国マンチェスター大学のKaragama氏らと会合する讃岐氏(前列左)
関連リンク
最終更新日 平成30年11月15日


