2017年度 研究事業成果集 再生医療製品の試験法・評価法の確立を目指す
 再生医療製品におけるレギュラトリーサイエンスの確立に向けた取り組み
再生医療製品におけるレギュラトリーサイエンスの確立に向けた取り組み
創薬戦略部 医薬品等規制科学課
再生医療製品の試験法・評価法に関する国際的なコンセンサス形成
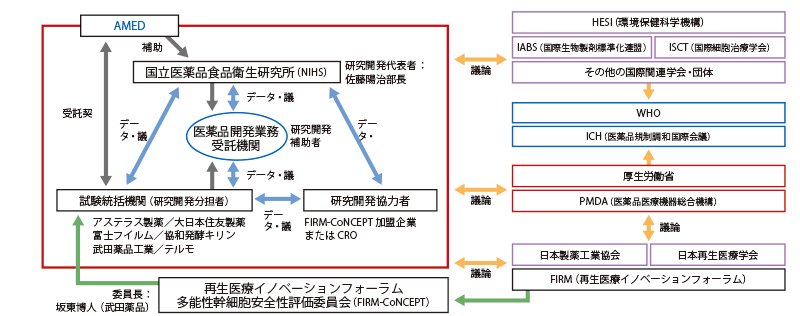
再生医療製品の開発が急速に進んでいますが、従来の医薬品などとは性質が異なるため、安全性の評価方法が十分確立されていないという問題があります。国立医薬品食品衛生研究所(NIHS)の佐藤陽治部長を中心とする官民共同チームは、再生医療製品の造腫瘍性のリスク評価に関するプロトコルを作成し、それに基づいた多施設共同研究を実施しました。研究を通じて再生医療製品の安全性に関する国際的なコンセンサスの形成を目指しています。
背景
ES細胞やiPS細胞などを使った細胞加工製品(以下、再生医療製品)の開発・実用化が急速に進んでいます。その一方で、再生医療製品は従来の医薬品などとは異なる全く新しい製品であるため、安全性や品質の評価方法が十分に確立されていません。例えば、再生医療製品は生きた細胞を含むため、製品中の細胞が異常増殖をして腫瘍を形成する(以下、造腫瘍性)という重大なリスクがありますが、どうすれば造腫瘍性の評価ができるのかについては明確な基準がなく、国際的な議論の場も存在しません。
医療製品の薬事規制や評価法について国際的なコンセンサスが形成されていないと、国境を越えた製品の流通が難しくなります。日本の患者さんは外国で開発された製品を使うことができず、日本の企業は開発した製品を海外に販売できないということになります。
再生医療製品におけるこの問題を解決するため、NIHS再生・細胞医療製品部の佐藤陽治部長と、産業界の団体である再生医療イノベーションフォーラム 多能性幹細胞安全性評価委員会(FIRM-CoNCEPT)を中心とする官民共同チームは、AMEDの医薬品等規制調和・評価研究事業において、再生医療製品の造腫瘍性に焦点を当てて、安全性評価方法の確立と、その評価法の国際的なコンセンサスの形成に向けた研究に取り組んでいます。
取り組み
研究チームは、①再生医療製品が腫瘍発生リスクを引き起こす問題点とその評価法についての考え方を、国内外動向を踏まえ整理するとともに、国内外にすでに存在する造腫瘍性に関する試験法と評価法について調査を行いました。次に、②多くの種類の再生医療製品に利用可能な造腫瘍性に関する試験法について、標準プロトコル(試験計画)を作成し、試験法の検出限界・特異性・精度・陽性対照細胞のあり方、結果の再現性などを多施設で比較・検証し、それぞれの試験法の有用性・再現性を明らかにしました。
①、②より得られた成果を基に、海外の産学官関係者らと共に造腫瘍性評価の考え方及び評価方法について議論を展開し、国際的なコンセンサスを作ることを目指しています。
成果
再生医療製品の造腫瘍性に関する試験法についての客観的なデータを世界に先駆けて示すことで、国際的な議論を始めるための土台を築きました。これにより国際的なコンセンサス作り、ガイドライン作りにおいて我が国が大きく貢献できると期待できます。
展望
多施設におけるプロトコルに基づく試験が終了した後は、試験の場を海外に広げてさらなる検証を重ねます。同時に、国際NPO組織HESIの細胞治療安全性評価のための委員会を始めとする議論の場で、再生医療製品の安全性評価に関する国際的なガイドライン策定を目指した情報発信に取り組んでいきます。
最終更新日 平成30年11月15日


