2018年度 研究事業成果集 脊髄損傷治療のための自己骨髄間葉系幹細胞の実用化
 「先駆け審査指定制度」(再生医療等製品)の承認第1号に
「先駆け審査指定制度」(再生医療等製品)の承認第1号に
札幌医科大学の本望修教授と山下敏彦教授を中心とする研究グループは、脊髄損傷の患者さんを対象とした医師主導治験を実施し、「自己骨髄間葉系幹細胞(治験薬識別コード:STR01)」が脊髄損傷に伴う神経症候および機能障害に対して一定の治療効果と安全性を示すことを確認しました。この結果をもとに製造販売承認申請を行い、2018年12月に厚生労働省より「条件及び期限付」で承認を取得しました。
取り組み
脊髄損傷の患者さんは日本に10万人以上存在し、毎年5,000人以上が新たに発生しています。比較的若年で受傷する患者さんの多く、重い後遺症が残ったまま、その後の長い人生を過ごす場合が多いといわれています。
現在の標準治療としては、脊髄損傷の程度を可能な限り軽減するための受傷後急性期に行われる手術療法と、その後の残存した神経機能に対するリハビリテーションのみであり、損傷した脊髄を修復し、喪失した神経機能の改善を目的とする治療法はありません。したがって、再生医療により損傷した脊髄を修復し、喪失した神経機能の回復を促進するなどの新しい治療法の開発が強く望まれてきました。
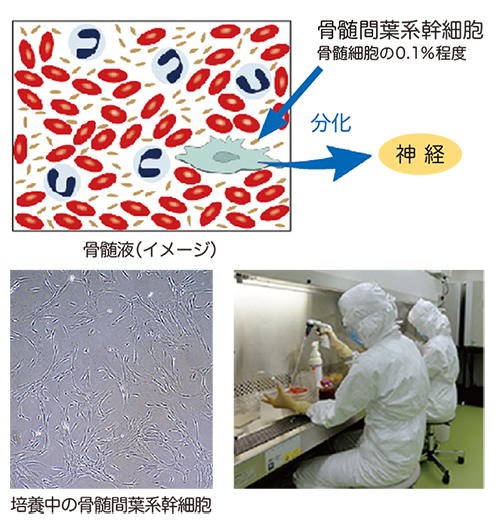
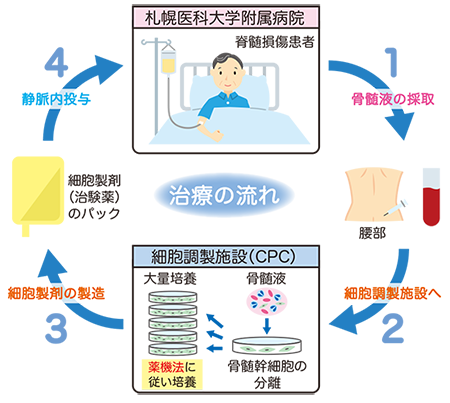
そこで研究グループは、患者さんの骨髄液より採取した自己骨髄間葉系幹細胞(図1)を体外で培養・増殖し、脊髄損傷の患者さんの静脈内に投与する細胞療法の医師主導治験を2013年12月より札幌医科大学附属病院において開始しました(図2)。また、2016年2月には厚生労働省より、再生医療等製品の先駆け審査指定制度*の対象品目の指定を受けました。
- * 先駆け審査指定制度:
- 対象となる疾患の重篤性など、一定の要件を満たす画期的な新薬などについて、開発の早期段階から対象品目に指定し、薬事承認に関する相談・審査で優先的な取り扱いをすることで、承認審査の期間を短縮(通常の承認審査期間の約半分)することを目的とした制度。
成果
2017年2月に終了した医師主導治験の結果、脊髄損傷の患者さん13例のうち12例で投与後220日目に神経学的および機能学的分類の基準であるASIA機能障害尺度で1段階以上の改善が見られ、喪失した神経機能の回復などの治療効果が推定されました。重篤な有害事象の発現はなく、安全性も確認されました。
この結果を受け、共同開発企業であるニプロ株式会社が2018年6月に製造販売承認申請を行い、2018年12月28日付で厚生労働大臣より、再生医療等製品「自己骨髄間葉系幹細胞(治験薬識別コード:STR01)」の製造販売が「条件及び期限付(7年)」で承認されました。これは先駆け審査指定制度で指定された再生医療等製品としては最初の承認品目となります。
現在はステミラック注®として薬価基準に収載され、患者さんの治療が開始されています。
展望
承認後7年の間に治療実績を積み重ねることで、本製品の有効性等を明らかにし「、条件及び期限付」ではない承認が得られるように研究を進めていきます。また、自己骨髄間葉系幹細胞は脊髄損傷のみならず、多くの神経系疾患への応用が可能と考えられるため、本製品の適応拡大のための基礎・臨床研究を継続して行い、将来はより多くの患者さんの治療に使用されることが期待されます。
本邦における再生医療等製品の早期実用化の先駆けとして、今後も最先端の再生医療研究を推進していきます。
最終更新日 令和2年6月23日


