AMEDシンポジウム2017開催レポート:成果報告② がん研究と若手育成(1)
 成果報告➁ がん研究と若手育成
成果報告➁ がん研究と若手育成
間野 博行氏(東京大学大学院医学系研究科細胞情報学分野 教授、国立がん研究センター研究所長)
肺がんの原因となる遺伝子EML4-ALK融合型チロシンキナーゼの発見者である間野博行氏(東京大学 教授)。がんの原因遺伝子を特定し、その機能を抑える分子標的薬によってがんを治療する方法の治療効果はめざましく、国も「がんゲノム医療推進コンソーシアム懇談会」をスタートさせるなど、がんの個別化医療・ゲノム医療の実現に向けて大きな期待が高まっています。これからのがん研究について、また、次世代を担うがんの若手研究者育成について、間野先生からご講演をいただきました。

がんの原因となる異常タンパク質を研究
今から十数年前まで、がんの基礎研究は必ずしも臨床に直結した世界ではありませんでした。しかし、基礎研究の成果として優れた薬効の分子標的治療薬が出現して以降、一気に臨床とリンクし、薬剤開発のスピードも加速する時代となりました。
黎明期の分子標的治療薬は正常細胞の増殖に重要な分子を抑えるものであり、がんの治療にあまり有効性が認められませんでした。そこで、それぞれのがんの原因となる異常たんぱく質をがん研究によって明らかにし、それを押さえる薬剤を開発すれば臨床的有効性が高いのではないかという仮説が打ち出されました。
この仮説に基づき、私の研究室では、直接的な発がん原因たんぱく質をスクリーニングする技術を開発し、それを肺がんに適用したところ、EML4-ALK融合型チロシンキナーゼを見つけることができました。肺がんの中でEML4とALKという異なった遺伝子が染色体転座を起こし、融合型のチロシンキナーゼが作られていることが明らかになったのです。
ALKは細胞を増殖する酵素です。一部の肺がん患者においてALKがEML4と融合すると、酵素活性が数百倍に増強し、がんにならざるを得ない状況になることがわかりました。ならばALK阻害剤を作れば、全く新しい治療薬になると期待されました。
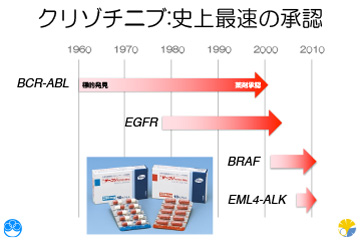
2007年にEML4-ALKが発見されてからわずか4年後に、ファイザー社が最初のALK阻害剤クリゾチニブを実用化しました。通常のがん治療薬、例えば白血病の原因遺伝子BCR-ABL融合型チロシンキナーゼが見つかってから特異的阻害剤が承認されるまでには、40年かかっています。発見から承認までたった4年というのは、がん治療薬の開発市場で圧倒的な速さでした。
原因遺伝子でがんを分類する時代に
スピードだけではなく、治療効果についても目覚ましい発展がありました。クリゾチニブ単剤で7割近い奏効率が得られたのです。しかし、残念ながらクリゾチニブ治療中に耐性が生じることがあり、私たちはその耐性機構も明らかにしました。耐性が生じるメカニズムが解明されたことで、多くの製薬会社によって、第2世代のALK阻害剤が次々に開発されていきました。ALK阻害剤の一つ、アレクチニブは奏効率が94%と、歴史上最も効果の高い抗がん剤です。最も有効な固形腫瘍に対する抗がん剤は、日本での基礎研究から生まれたのです。
また、当研究室の発見を機に、ALKは小児の腎臓がんでビンキュリンと融合すること、大人の卵巣肉腫ではフィブロネクチン1と融合してがんを発生することが分かりました。
今まで腎臓がんと肺がんは全く異なるがんと考えられていましたが、同じ特効薬で治療できる可能性が出てきたわけです。
これまでは、臓器別あるいは病理学上の観点からがんを分類し、治療薬を選択してきましたが、これからは、原因遺伝子によってがんを分類する時代に突入したと思われます。言い換えればどの遺伝子によって起きたがんかを調べて、最適な薬を患者に届ける時代になったのです。
このほかにも私の研究グループは、ROS1という遺伝子が他の遺伝子と融合して肺腺がんを作ること、RETという遺伝子も同様な融合によって肺がんを起こすことを解明しました。肺腺がんの原因遺伝子のうちRETは頻度が低いため、国立がん研究センター東病院の後藤功一博士のグループが全国レベルのスクリーニングシステムを構築し、RET阻害剤であるバンデタニブの臨床試験を行いました。ALKやRETなど、一研究者が見つけた成果をもとに、極めて早いスピードで患者のもとに届けられる時代になったといえます。
最終更新日 平成29年10月17日