AMEDシンポジウム2017開催レポート:成果報告➅ ヒトiPS細胞技術を活用した薬理試験法の開発と国際標準化(1)
 成果報告➅ ヒトiPS細胞技術を活用した薬理試験法の開発と国際標準化
成果報告➅ ヒトiPS細胞技術を活用した薬理試験法の開発と国際標準化
諫田 泰成氏(国立医薬品食品衛生研究所 薬理部長)
医薬品開発において、臨床試験に入る前に非臨床試験の段階で副作用を予測することが重要です。特に、重篤な不整脈であるTorsades de pointes(以下、TdP)などの心毒性に対する試験は、日米EU医薬品規制調和国際会議(ICH)のガイドラインに制定されています。この試験法は有用ですが限界もあることが指摘されており、ヒトにおいてさらに予測性の高い試験法が求められています。
ヒトiPS細胞は、非臨床試験の段階からヒトの細胞で試験を行うことができるため、新たな安全性薬理試験のツールとして大変に期待が高まっています。そこで国立医薬品食品衛生研究所を中心とした産官学の研究グループは、ヒトiPS細胞由来の心筋シートを使った薬理試験法を開発しました。大規模な検証実験では医薬品によるTdPの発生リスクを高精度で予測できる結果が得られ、ヒトiPS細胞を用いた試験法が有用であることを明らかにしました。

はじめに
創薬プロセスでは、動物を用いた非臨床試験で安全性を確認した上で、初めてヒトによる臨床試験に進みます。しかし、この段階で予期せぬ重篤な副作用が発生することや臨床試験で有効性が認められないことなどにより、開発中止に至る例も少なくありません。創薬における「死の谷」を克服し日本から新薬を出していくためには、ヒトにおける予測性が高い試験法の開発が重要です。
ヒトiPS細胞を用いたレギュラトリーサイエンス研究
レギュラトリーサイエンスとは、科学的な知見に基づいて医薬品等の品質・有効性・安全性を適正かつ迅速に予測・評価・判断することです。より安全な医薬品をいち早く患者さんに届けるためには、非臨床試験、臨床試験、市販後調査などそれぞれの創薬プロセスにおいてレギュラトリーサイエンス研究を推進する必要があります。
ヒトiPS細胞技術は、従来の創薬プロセスとは異なり、ターゲット化合物の探索、非臨床試験の段階からマウスなどの動物ではなくヒト細胞を用いた評価が可能になるため、非常に有用なツールとなり得ると期待されています。
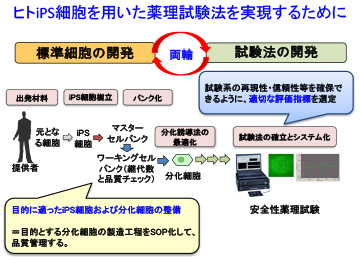
特に、ヒトiPS細胞を用いた非臨床試験を実現するためには、心筋や神経、肝臓など目的にかなった細胞を作製する「標準細胞の開発」と試験系の再現性・信頼性を確保できるような適切な評価指標を選定する「試験法の開発」を車の両輪のように並行して取り組む必要があります。
重篤不整脈に対する新たな試験系の必要性
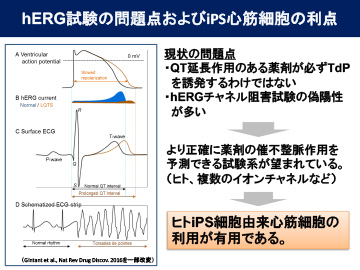
医薬品による有害作用の原因となる臓器は、心臓、神経、肝臓で7割程度を占めるとの報告があります。医薬品の市場撤退理由に対する調査では、重篤な不整脈であるTorsades de pointes(以下、TdP)や心血管系などの心毒性によるものが約半数にも達しています。
現在、医薬品候補化合物の心毒性は、hERGチャネルの阻害活性を指標にするhERG試験法によって評価されています。医薬品候補化合物によってhERGチャネルが阻害されてQT間隔が延長することにより致死的なTdPにつながると考えられるため、QT間隔の延長により化合物のTdPリスクを評価してきました。しかし、必ずしもQT延長がTdP発生につながらないこと、hERGチャネル阻害試験では偽陽性が多いことなどhERG試験法の限界も指摘されています。ヒトiPS細胞由来心筋細胞は、hERG以外のイオンチャネルも発現しているため、今まで以上に催不整脈リスクを評価でき、ヒトにおける安全性をより高めた方法になると期待されています。
そこで、国立医薬品食品衛生研究所、日本安全性薬理研究会、製薬企業などからなる研究グループは、厚生労働省やPMDA(医薬品医療機器総合機構)などを含むオールジャパンの産学官体制を構築して、AMEDの支援のもと、ヒトiPS細胞を使った試験法の実現に向けて取り組んでいます。
最終更新日 平成29年10月17日