プレスリリース 患者さん由来iPS細胞を用いた薬の神経毒性評価モデルの構築
プレスリリース
京都大学iPS細胞研究所(CiRA)
京都府立医科大学
国立研究開発法人日本医療研究開発機構(AMED)
ポイント
- iPS細胞由来の心筋細胞や肝細胞を用いた毒性評価系と異なり、iPS細胞由来の神経細胞では、どのような毒性評価系が、実際の臨床的副作用を反映した評価系なのかは明らかではない。
- シャルコー・マリー・トゥース病(CMT)(Charcot-Marie-Tooth病;CMT)は最も頻度の高い遺伝性末梢神経疾患で、世界中でおよそ2,500人に1人の割合で患者がいる。筋萎縮や感覚障害、足変形といった症状がゆっくりと進行する。抗がん剤の副作用の神経障害を呈しやすい場合があることが知られている。
- CMT患者さんiPS細胞由来神経細胞は、ミトコンドリア(注1)の形態異常と機能低下を示した。
- 健康な方とCMT患者さんiPS細胞由来神経細胞は、どちらも抗がん剤投与により神経突起内でミトコンドリアの凝集が増加したが、CMT患者さんiPS細胞由来神経細胞でより顕著であった。
- ミトコンドリアの異常凝集が、臨床的副作用を反映する神経毒性評価の指標となることを示し、新たな神経毒性評価モデルを構築した。
- 今後、CMT患者さんiPS細胞由来神経細胞のミトコンドリア異常凝集を用いた本評価法は、CMT治療薬剤探索の指標になると考えられる。
1.要旨
CMTは、最も頻度の高い遺伝性末梢神経疾患で、その一部はミトコンドリアの融合や移動に関わるMFN2というタンパク質をつくるMFN2遺伝子の異常(変異)によって起こります。また、CMT患者さんに抗がん剤を投与すると、副作用により、神経障害の悪化を来しやすいことが知られています。本研究では、2人のCMT患者さんからiPS細胞を作製し、神経細胞へと分化させました。すると、CMT患者さん由来神経細胞では、ミトコンドリアが小さく、ミトコンドリアの数や動きが低下していることが分かりました。また、健康な方とCMT患者さんiPS細胞由来神経細胞に抗がん剤を投与すると、どちらもミトコンドリアの異常な凝集が観察されましたが、CMT患者さんiPS細胞由来神経細胞でより顕著でした。この特徴は実際の臨床と同様にCMT患者さんが、抗がん剤の副作用の神経障害を呈しやすいことを反映しており、薬の副作用をiPS細胞由来神経細胞で評価する指標の一つとなることが示され、本細胞モデルが新たな神経毒性評価系として有用であることが示唆されました。
この研究成果は2016年11月9日に米国科学誌「Clinical Pharmacology & Therapeutics」でオンライン公開されました。
2.研究の背景
そこで、井上教授らの研究グループは、抗がん剤による副作用を呈しやすいことが知られているCMT患者さん由来iPS細胞から神経細胞を作製し、薬の神経毒性評価モデルの構築を目指しました。
3.研究成果
1)CMT患者さんiPS細胞由来神経細胞では、ミトコンドリアの形態異常と機能低下を示した
まず、本研究グループは、MFN2遺伝子に変異をもつ2名のCMT患者さんの末梢血細胞からiPS細胞を作製しました。そして、iPS細胞から神経細胞へと分化させました。CMT患者さんiPS細胞由来神経細胞では、健康な方と比較してMFN2タンパク質が増加しており、MFN2遺伝子の変異によりMFN2タンパク質の生化学的特性が変化していることが示唆されました。
MFN2タンパク質はミトコンドリア融合に役割を果たすことが知られており、また、CMT患者さんの腓腹神経細胞(注2)の軸索中に、健康な方のものより小さく、丸い異常なミトコンドリアが凝集していたことが報告されています。そこで、グループがCMT患者さん由来神経細胞のミトコンドリアを電子顕微鏡を用いて観察したところ、健康な方と比較して、ミトコンドリアが小さく異常な形態を示していることが分かりました。
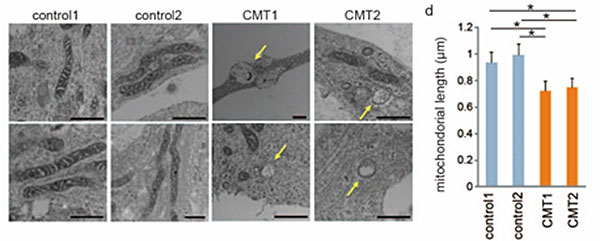 図1.神経細胞内ミトコンドリアの電子顕微鏡画像
図1.神経細胞内ミトコンドリアの電子顕微鏡画像CMT患者さんiPS細胞由来神経細胞のミトコンドリアは健康な方に比べて小さく、形態異常を示した。
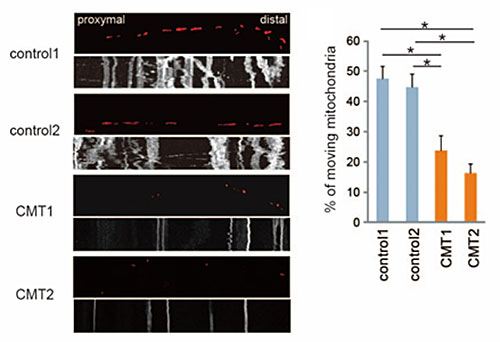 図2.タイムラプスイメージングによる神経突起内ミトコンドリアの動きの解析
図2.タイムラプスイメージングによる神経突起内ミトコンドリアの動きの解析CMT患者さん由来神経細胞では、健康な方に比べて移動しているミトコンドリアの数が減少していた。
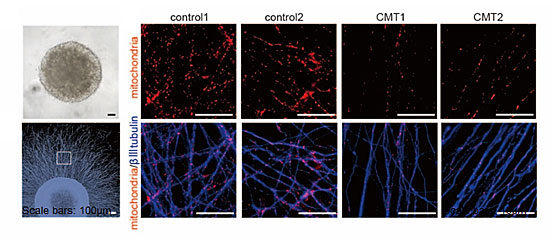 図3.神経突起内のミトコンドリア
図3.神経突起内のミトコンドリア
神経突起内のミトコンドリア数を計測した。CMT患者さん由来神経細胞では、神経突起内のミトコンドリア数が健康な方より低下していた。(赤色:ミトコンドリア、青色:神経突起)
また、CMT患者さん由来神経細胞では、神経突起内のATPレベルも低く、ミトコンドリアの機能不全を呈していることが示唆されました。
2)CMT患者さん由来の神経細胞を用いることで、臨床的副作用を反映した神経毒性評価モデルを構築した
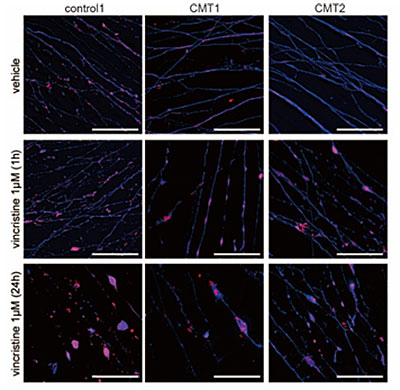 図4.抗がん剤暴露による神経突起内のミトコンドリア凝集
図4.抗がん剤暴露による神経突起内のミトコンドリア凝集
4.まとめ
本研究では、薬剤に対して神経毒性の副作用を呈しやすいこと知られているCMT患者さんiPS細胞由来神経細胞を用いることにより、薬剤投与により生じた神経突起内のミトコンドリア異常凝集が、薬の副作用を評価する指標の一つとなることを示しました。本細胞モデルが新たな神経毒性評価系として有用であることが示唆されました。
薬による神経毒性は、その毒性を示す部位により大きく、軸索障害と細胞体障害、髄鞘障害に分けられ、それぞれ異なるメカニズムによって起こります。本研究の神経毒性評価系は薬剤性軸索障害のモデルであり、今後、細胞体障害や髄鞘障害といった他のタイプの神経毒性においてもiPS細胞を用いた毒性評価系の構築が期待されます。また、今後、CMT患者さんiPS細胞由来神経細胞の神経突起内のミトコンドリア異常凝集などが、薬剤の探索の指標になると考えられます。
5.論文名と著者
- 論文名
- “Modeling drug-induced neuropathy using human iPSCs for predictive toxicology”
- ジャーナル名
- Clinical Pharmacology & Therapeutics
- 著者
- Ryo Ohara1,2*, Keiko Imamura1*, Fukiko Morii1,2, Naohiro Egawa1, Kayoko Tsukita1, Takako Enami1, Ran Shibukawa1, Toshiki Mizuno2, Masanori Nakagawa2, Haruhisa Inoue1#
* 筆頭著者
# 責任著者 - 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 京都府立医科大学
6.本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- AMED 再生医療実用化研究事業
-
AMED 再生医療実現拠点ネットワークプログラム(疾患特異的iPS細胞を活用した難病研究)
- AMED 再生医療実現拠点ネットワークプログラム(iPS細胞研究中核拠点)
- AMED 難治性疾患克服研究事業
- 公益財団法人 持田記念医学薬学振興財団
- 公益財団法人 第一三共生命科学研究振興財団
7.用語説明
- (注1)ミトコンドリア
- 細胞内にある細胞小器官。細胞に必要なエネルギーをATP(アデノシン三リン酸)という形で合成する。細胞内では分裂と融合を繰り返し、その形態を変化させる。
- (注2)腓腹神経細胞
- 腓腹神経は下肢を走行する末梢神経の一種であるが、それを構成する神経細胞のこと。
- (注3)ATP(アデノシン三リン酸)
- 体内に広く存在する分子で、エネルギーの放出や貯蔵に関わり、エネルギーを必要とする体内での化学反応に用いられている。「生体のエネルギー通貨」と呼ばれている。
お問い合わせ先
本件担当
京都大学iPS細胞研究所(CiRA)
研究支援部門 国際広報室
TEL:075-366-7005 FAX:075-366-7185
E-mail:media“AT”cira.kyoto-u.ac.jp
京都府立医科大学 広報センター
〒602-8566 京都市上京区河原町広小路上る梶井町465
TEL:075-251-5275
E-mail:kouhou“AT”koto.kpu-m.ac.jp
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 再生医療研究課
〒100-0004 東京都千代田区大手町一丁目7番1号
TEL:03-6870-2220 FAX:03-6870-2242
E-mail:saisei“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 平成28年11月28日
最終更新日 平成28年11月28日


