プレスリリース がん細胞の生存・転移に重要なタンパク質を狙い撃ちする化合物を開発―難治性がんに対する新しい治療薬の創出に期待―
プレスリリース
国立大学法人九州大学
国立大学法人東京大学
国立研究開発法人理化学研究所
国立研究開発法人日本医療研究開発機構
九州大学生体防御医学研究所の福井宣規主幹教授、宇留野武人准教授、大学院医学系学府博士課程4年生の田尻裕匡らの研究グループは、東京大学大学院薬学系研究科の金井求教授、理化学研究所横山茂之上席研究員の研究グループと共同で、がん遺伝子Ras(※1)を介したがんの悪性化に、DOCK1というタンパク質が重要な役割を演じていることを発見し、その選択的阻害剤「TBOPP」を世界に先駆けて開発することで、DOCK1阻害によりがんの増殖および転移を抑制できることを実証しました。
がんは我が国の死因の第一位で、年間30万人以上の命を奪っており、重大な社会問題となっています。なかでもRas遺伝子の異常(変異)は、膵臓がんや大腸がんをはじめ多くのがんで認められ、がん全体の3分の1に及ぶにもかかわらず、いまだに有効な治療薬が無く、その対策は急務となっています。本研究グループは、変異Rasによるがんの生存および浸潤には、Rac(※2)という分子の活性化が必要であることに着目し、その制御因子であるDOCK1の機能を解析しました。その結果、DOCK1を発現できないように遺伝子操作したがん細胞では、低栄養条件下での生存性および浸潤能が著しく低下することを見いだしました。そこで、20万を超える化合物ライブラリーをスクリーニングし、ヒット化合物の構造最適化を行い、DOCK1の選択的阻害剤(TBOPPと命名)の開発に成功しました。TBOPPをマウスに投与することで、変異Rasを有するがん細胞の増殖および転移が抑制できます。以上より、TBOPPは変異Rasを有するがんを治療するための新たな創薬リード(※3)になることが期待されます。
本研究成果は、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業インキュベートタイプ(LEAP)および次世代がん研究シーズ戦略的育成プログラム(P-DIRECT)の成果で、2017年5月2日(火)正午(米国東部夏時間)に米国科学雑誌「Cell Reports」に掲載されます。
- 研究者からひとこと:
- DOCK1阻害剤を開発し、がん治療に貢献したいという私達の夢が、一歩実現に近づきました。より効果的で、安全な新しい抗がん剤の創出を目指して、今後さらに研究を進めて参ります。
背景
がんは我が国の死因の第一位であり、三人に一人ががんで亡くなる時代となっています。Rasはヒトにおいて最初に同定されたがん遺伝子であり、その変異は、がん全体の3分の1に認められるとも言われています。しかしながら、現在までのところ、変異Rasを持つがんに対する有効な治療薬は開発されておらず、その対策は急務となっています。
正常細胞においてRasは「分子スイッチ」として機能しており、細胞外から刺激を受けた場合にのみ、不活性型(スイッチOFF)から活性型(スイッチON)に変換され、増殖や生存といった細胞活動を支える働きをしています。一方、変異によってRasが常時活性型になると、がん細胞はマクロピノサイトーシス(※4)を介して細胞外からの栄養分の取り込みを促進させ、低栄養条件下でも生存・増殖できるように変化すると共に、周辺組織に浸潤し、血管やリンパ管を介して遠隔転移するようになります。これまでの研究から、変異Rasによって誘導されるがんの悪性化には、Racの活性化が必要であることが知られていましたが、その活性化に関わる分子については不明でした。
内容
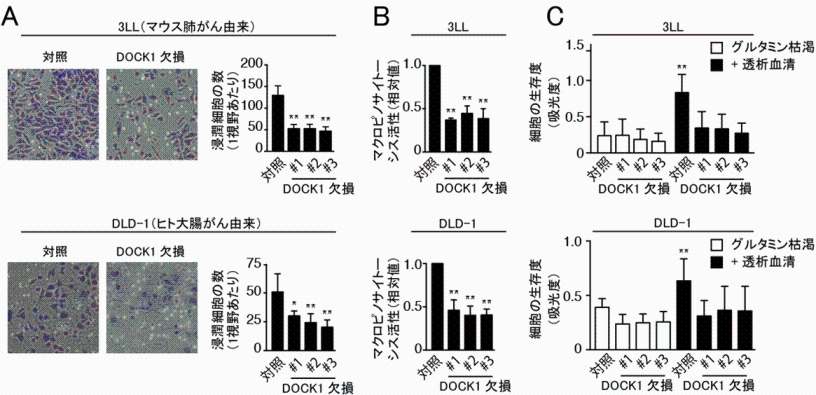 図1.Rasに変異を持つがん細胞の浸潤、マクロピノサイトーシス、および低栄養条件下での生存は、DOCK1の遺伝子欠損によって抑制される。
図1.Rasに変異を持つがん細胞の浸潤、マクロピノサイトーシス、および低栄養条件下での生存は、DOCK1の遺伝子欠損によって抑制される。
A:DOCK1欠損がん細胞では、対照となる細胞に比べて、浸潤能が抑制されている。
B:DOCK1欠損がん細胞では、対照となる細胞に比べて、マクロピノサイトーシスが抑制されている。
C:DOCK1欠損がん細胞では、対照となる細胞に比べて、低栄養条件下での生存性が低下する。
上段:3LL(マウス肺がん由来細胞)、下段:DLD-1(ヒトの大腸がん由来細胞)、#はクローン番号を示す。
DOCK1には免疫細胞の遊走・活性化に重要なDOCK2という近縁分子が存在する事から、がん治療のためには選択的にDOCK1を阻害することが必要となります。そこで、20万を超える化合物ライブラリーをスクリーニングし、ヒット化合物の構造最適化を行い、最終的に薬効やDOCK1選択性の点で優れた化合物としてTBOPPを開発しました(図2A)。TBOPPで処理したがん細胞は、DOCK1欠損細胞の場合と同様に、浸潤応答やマクロピノサイトーシス、低栄養条件下での生存性が顕著に抑制されました(図2B, C, D)。一方、免疫細胞の運動にはDOCK2を介したRac活性化が重要な役割を演じることが知られていますが、TBOPPは同じ濃度で、免疫細胞の動きには全く影響を与えませんでした。このことから、TBOPPは、細胞レベルにおいてもDOCK1とDOCK2を識別していることが明らかになりました。
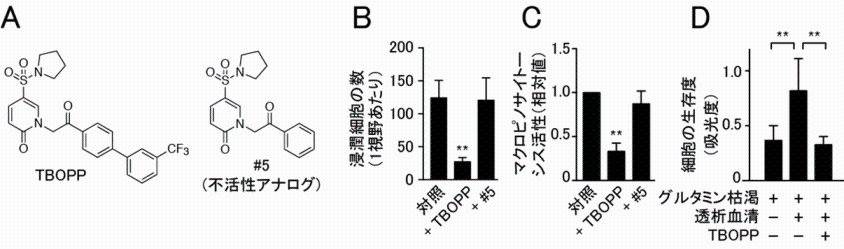 図2.DOCK1選択的阻害剤TBOPPは、変異Rasを有するがん細胞の浸潤、マクロピノサイトーシス、生存を抑制する。
図2.DOCK1選択的阻害剤TBOPPは、変異Rasを有するがん細胞の浸潤、マクロピノサイトーシス、生存を抑制する。
A:TBOPPとDOCK1阻害活性のないアナログ(#5)の構造。
B:TBOPPは、マウス肺がん細胞株3LLの浸潤を抑制する。
C:TBOPPは、3LL細胞のマクロピノサイトーシスを抑制する。
D:TBOPPは、3LL細胞のグルタミン欠乏条件下での生存を抑制する。
最後に、動物個体内において、TBOPPががんの増殖や転移をブロックできるかを検討しました。マウスにTBOPPを投与すると、図3Aに示すように、高転移性がん細胞株の肺転移が顕著に抑制されました。また、肺がん細胞株や大腸がん細胞株の生着・増殖も抑制されました。このことは、DOCK1の選択的阻害が、変異Rasを持つがんに対する新しい治療薬となる可能性を示しています。
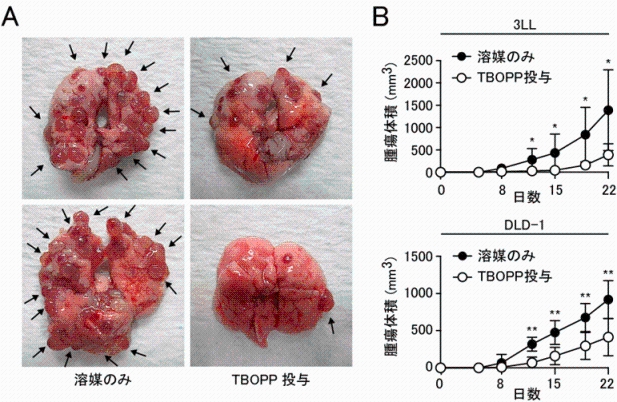 図3.DOCK1阻害剤の投与によって、がんの転移および増殖が抑制される。
図3.DOCK1阻害剤の投与によって、がんの転移および増殖が抑制される。
B:マウス肺がん細胞株3LL(上段)とヒト大腸がん細胞株DLD-1(下段)の増殖は、TBOPP投与によって抑制される。
今後の展開
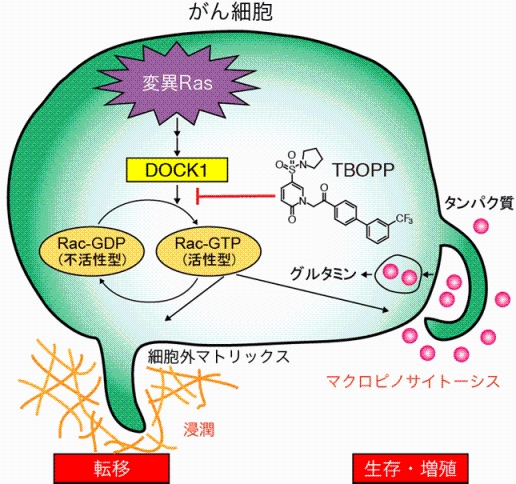 図4.変異Rasによるがん細胞の悪性化とDOCK1の働き(模式図)
図4.変異Rasによるがん細胞の悪性化とDOCK1の働き(模式図)
本研究について
用語解説
- (※1)Ras:
- 1982年に、ヒトにおいて最初に発見されたがん遺伝子である。通常は分子スイッチとして機能するが、恒常的に活性型として存在するような変異が起きると、細胞内で常にスイッチがONの状態となって、がん化を引き起こす。
- (※2)Rac:
- Rasと同様に分子スイッチとして機能する分子であるが、主に細胞の形態変化を誘導することで、細胞運動やマクロピノサイトーシスに重要な役割を演じている。今回同定した創薬標的であるDOCK1は、Racを活性型に変える機能を有する分子である。
- (※3)創薬リード:
- 細胞レベルおよび個体レベルで有用性が確認されたもので、実際臨床の現場で用いられる薬の元となる化合物。
- (※4)マクロピノサイトーシス:
- 細胞膜の一部が変形して、細胞外の栄養源を細胞内に取り込む現象。
- (※5)細胞外基質:
- コラーゲンといった細胞外に存在する様々な物質の総称。
論文名
“Targeting Ras-Driven Cancer Cell Survival and Invasion through Selective Inhibition of DOCK1”
(DOCK1の選択的阻害によってRasが引き起こすがん細胞の生存と浸潤を狙い撃ちする)
雑誌名:Cell Reports
お問い合わせ
内容に関するお問い合わせ
九州大学生体防御医学研究所
准教授 宇留野 武人(うるの たけひと)
電話:092-642-6830 FAX:092-642-682
Mail:uruno“AT”bioreg.kyushu-u.ac.jp
主幹教授 福井 宣規 (ふくい よしのり)
電話:092-642-6828 FAX:092-642-6829
Mail:fukui“AT”bioreg.kyushu-u.ac.jp
報道に関するお問い合わせ
九州大学広報室
電話:092-802-2130 FAX:092-802-2139
Mail:koho“AT”jimu.kyushu-u.ac.jp
東京大学薬学部庶務チーム
電話:03-5841-4719 FAX:03-5841-4711
Mail:shomu“AT”mol.f.u-tokyo.ac.jp
理化学研究所 広報室 報道担当
TEL:048-467-9272 FAX:048-462-4715
Mail:ex-press“AT”riken.jp
事業に関するお問い合わせ
※革新的先端研究開発支援事業
国立研究開発法人日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課
電話:03-6870-2224
Mail:kenkyuk-ask“AT”amed.go.jp
※次世代がん研究シーズ戦略的育成プログラム
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 がん研究課
電話:03-6870-2221
Mail:cancer“AT”amed.go.jp
※Mailは上記アドレス“AT”の部分を@に変えてください。
関連リンク
掲載日 平成29年5月3日
最終更新日 平成29年5月3日


