Rac1発がん性タンパク質の恒常活性化の分子機構を解明
 隠れた未知の薬剤結合部位の発見による新規創薬研究戦略
隠れた未知の薬剤結合部位の発見による新規創薬研究戦略
東京大学の嶋田一夫教授らの研究グループは、核磁気共鳴(NMR)法*を用いてRac1発がん性変異体タンパク質の恒常活性化の分子機構を明らかにしました。さらに、既知のRac1立体構造において見いだされていなかった隠れた薬剤結合部位を発見することに成功しました。本研究に基づき、薬剤の設計が困難であった創薬標的タンパク質においても、薬剤結合部位を新たに見いだすことにより薬剤設計が可能になることが期待されます。
- * 核磁気共鳴(NMR)法:
- タンパク質を構成する水素、炭素、窒素原子の核スピンとラジオ波との相互作用を利用することで、タンパク質の立体構造ならびに造多型を解析する手法。 他のタンパク質立体構造解析法であるX線結晶構造解析法やクライオ電子顕微鏡法と比較して、タンパク質が活性を発揮する溶液条件下において、その機能と関連するタンパク 質の運動性や構造多型の情報を得られることが特徴である。
取り組み
細胞増殖や細胞骨格の形成を担うRac1(Ras-related C3 botulinum toxin substrate 1)は、種々のがん細胞で変異が見いだされる強力ながん遺伝子産物であり、抗がん剤の有効な標的分子です。しかしながら、発がん性変異体においてなぜ恒常活性化が生じるのか、詳細な分子機構は明らかとなっていませんでした。また、Rac1の分子表面には薬剤が結合し得るポケットが存在しないことが知られており、薬剤の設計が困難な創薬標的であると考えられています。これらの問題のために、Rac1は有効な抗がん剤の標的タンパク質でありながらも、それを標的とする抗がん剤の開発は極めて困難でした。本研究では、生理的条件下におけるタンパク質の動的構造が解析可能なNMR法を活用し、Rac1の正常タンパク質と発がん性タンパク質を詳細に比較しました。
成果
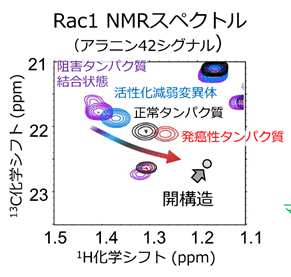
本取り組みの結果、Rac1にはグアニンヌクレオチド、ならびに補因子であるマグネシウムイオンの結合部位を形成するスイッチ1と呼ばれる領域に、およそマイクロ秒の時定数で遷移する構造多型が存在することが明らかになりました。
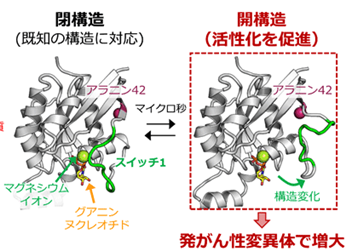
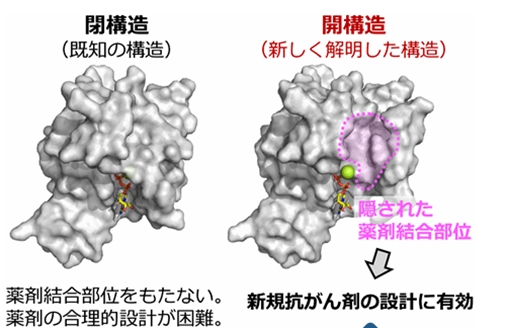
さらに、Rac1の活性化を阻害するタンパク質の結合状態、ならびに活性化が減弱する変異体とのNMRスペクトルの比較から(図1)、Rac1に内在する構造多型は、X線結晶構造の解析から得られた既知の立体構造に対応し、ヌクレオチドとマグネシウムの結合部位がスイッチ1により覆われた「閉構造」と、ヌクレオチドとマグネシウムイオンの解離が促進することで活性化状態に移行しやすい「開構造」との2種類の構造で説明可能であることを示しました。そして、発がん性変異体では開構造を形成する割合が大きく増大していることが示され、このことによって恒常的な活性化が生じていることを明らかにしました。さらに、タンパク質への部位特異的なラジカル修飾反応と、それに伴って生じるNMRシグナルの減弱を利用して原子間距離を多数測定することで、開構造のモデル構造を構築することに成功しました(図2)。得られたモデル構造に基づき、開構造ではスイッチ1領域が大きく開き、ヌクレオチドとマグネシウムイオンが解離しやすい構造であること、そして既知の閉構造には見いだされない隠れた薬剤結合部位が存在することを明らかにしました(図3)。
展望
本成果は、NMR法により見いだされるタンパク質の構造多型が、タンパク質の機能を理解する上で重要であることを示すのみならず、構造多型を解析することによって既知の立体構造には存在しない隠された薬剤結合部位を新たに発見可能であることを立証するものです。この新たに見いだされた薬剤結合部位に適合する化合物を設計することにより、Rac1を標的とする抗がん剤の開発が可能になることが期待されます。さらに、本研究で示された研究戦略を応用することによって、他の創薬標的タンパク質、特に薬剤結合部位が未知のタンパク質を対象とした創薬研究が可能になり、医薬品開発が大きく加速することが期待されます。
関連リンク
最終更新日 令和2年6月23日


