プレスリリース 3次元組織学による全臓器・全身の観察技術を確立―組織の物理化学的性質に基づき理想的なプロトコルを設計―
プレスリリース
理化学研究所
東京大学
日本医療研究開発機構
理化学研究所(理研)生命機能科学研究センター合成生物学研究チームの上田泰己チームリーダー(東京大学大学院医学系研究科システムズ薬理学教室教授)、洲﨑悦生客員研究員(同准教授)らの共同研究グループ※は、組織透明化技術[1]と組み合わせて利用できる全臓器・全身スケールの3次元組織染色・観察技術「CUBIC-HistoVIsion(CUBIC-HV)」を確立しました。
本研究成果は、現時点において世界で最も高効率な3次元組織染色手法を提供するもので、臓器・全身スケールでの生体システムの理解や、臨床病理学検査の3次元化による診断確度・客観性の大幅な向上に寄与すると期待できます。
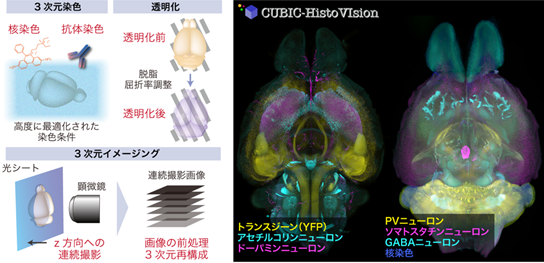
今回、共同研究グループは、経験則による組織染色プロトコル開発の限界を突破するため、生体組織の物理化学的物性を詳細に調べた結果、生体組織(特に透明化処理を行なった組織)が、主にタンパク質によって構成される「電解質ゲル[2]」の一種であることを再発見しました。この物性から組織を模倣できる人工ゲルを選別し、組織3次元染色の必須条件を探索するスクリーニング系を構築しました。さらに収集した必須条件を組み合わせることで、理想的な3次元染色プロトコルをボトムアップにデザインすることに成功しました。開発したCUBIC-HV法(CUBIC[3]に基づく3次元組織学・3次元イメージング)は、CUBIC透明化法、高速ライトシート顕微鏡[4]との組み合わせにより、マウスの全脳、マーモセットの半脳、ヒト脳組織ブロック等を均一に染色し、3次元的な全臓器組織観察を可能にしました。
本研究は、オンライン科学雑誌『Nature Communications』(4月27日付:日本時間4月27日)に掲載されます。
- ※共同研究グループ
- 理化学研究所
-
- 生命機能科学研究センター
-
- 合成生物学研究チーム
- チームリーダー 上田 泰己(うえだ ひろき)
(東京大学 大学院医学系研究科 システムズ薬理学教室 教授) - 客員研究員 洲﨑 悦生(すさき えつお)
(東京大学 大学院医学系研究科 システムズ薬理学教室 准教授) - 無細胞タンパク質合成研究チーム
- チームリーダー 清水 義宏(しみず よしひろ)
- 脳神経科学研究センター
-
- 神経老化制御研究チーム
- チームリーダー 西道 隆臣 (さいどう たかおみ)
- 東京大学 物性研究所 中性子科学研究施設 柴山研究室
- 教授 柴山 充弘 (しばやま みつひろ)
- 新潟大学 脳研究所
-
- システム脳病態学分野
- テニュアトラック 教授 田井中 一貴(たいなか かずき)
- 病理学分野
- 教授 柿田 明美(かきた あきよし)
- 東京大学
-
- 大学院医学系研究科 人体病理学・病理診断学分野
- 教授 牛久 哲男(うしく てつお)
- 大学院農学生命科学研究科 生物化学研究室
- 教授 東原 和成 (とうはら かずしげ)
- 京都大学大学院 医学研究科
-
- 脳機能センター
- 特定教授 尾上 浩隆 (おのえ ひろたか)
- 神経生物学
- 教授 伊佐 正 (いさ ただし)
背景
近年、光学顕微鏡を用いて生体組織を3次元的に観察することを可能にするさまざまな組織透明化技術が発表されています。理研の研究チームも、2014年にCell誌に掲載された第一世代CUBIC技術注1)を皮切りに、これまで10本以上の関連論文を発表し、この分野に貢献してきました。このような組織透明化・3次元観察技術の発展と普及により、現在、細胞や組織構造を染色してラベリングする組織化学的手法のニーズが高まっています。
しかし、3次元組織に染色剤や染色用抗体を浸透させることは、多くの場合容易ではありません。これまで、経験則に基づく3次元染色プロトコルが複数提案されていましたが、幅広い染色剤や抗体に適用できるものではありませんでした。核染色剤のような小分子でも時に浸透が難しいため、単純な分子サイズの問題ではなく、染色系が持つ複雑な物理化学的環境がその要因であると示唆されていました。このため、理想的な3次元染色プロトコルをデザインするには、染色系の環境、特に生体組織の物理化学的物性を詳しく解明する必要がありました。
研究手法と成果
共同研究グループは、理想的な3次元染色プロトコルをボトムアップにデザインすることを目指し、まず組織がどのような物質として定義できるかを検討しました。その結果、さまざまな化学的条件下(水・酸性・アルカリ性・高塩・有機溶剤など)で組織が繰り返す膨潤収縮の挙動を示す物質、すなわち「ゲル」であることを発見しました(図1)。
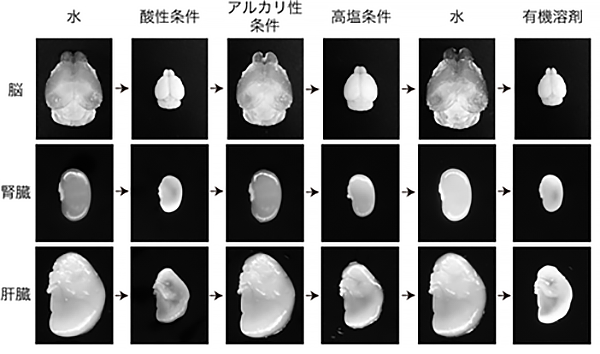
そこで、生体組織ゲルの膨潤収縮の挙動をさまざまな人工ゲルと比較したり(図2)、小角X線散乱法[5]と呼ばれる物質中のナノスケールオーダーの構造を解析する物理学的手法を使用したりするなどして、生体組織の物理化学的物性を詳しく調べました。その結果、生体組織(特に透明化処理を行なった組織)が主にタンパク質によって構成される「電解質ゲル」の一種であると結論づけました。この結果は、1980年代にアメリカで活躍されたゲル研究の第一人者、田中豊一博士の知見を再発見[6]したものとなりました。
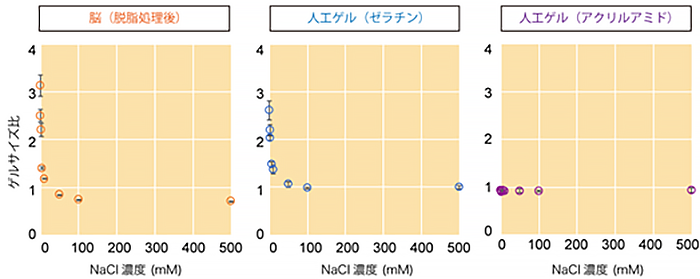
次に、生体組織ゲルの物性をもとに、生体組織ゲルを模倣できる人工ゲルを用いて、3次元染色条件を幅広く検討できるスクリーニング系を構築しました。本実験系により、どの染色条件が3次元染色に大きく影響するか(またはほとんど影響しないか)を定量的に評価することが可能になりました。その結果得られた3次元染色の必須条件を組み合わせ、理想的な3次元染色プロトコルをボトムアップにデザインすることに成功しました。本プロトコルは、CUBIC透明化法と組み合わせることで3次元的な組織構造の観察を可能にすることから、共同研究グループは「CUBICに基づく3次元組織学・3次元イメージング(three-dimensional histology and volumetric imaging on CUBIC)」を意味する「CUBIC-HistoVIsion(CUBIC-HVと略)」と命名しました。
さらに、CUBIC-HVによって準備された多数のサンプルを3次元イメージングするため、透明化した臓器観察に最適化した高速ライトシート顕微鏡「GEMINI システム」を導入しました。GEMINI顕微鏡システムは、マウス全脳をカバーする約2,000枚の顕微鏡写真を15分以内で撮影できる、非常に高速な撮影機能を持っています。
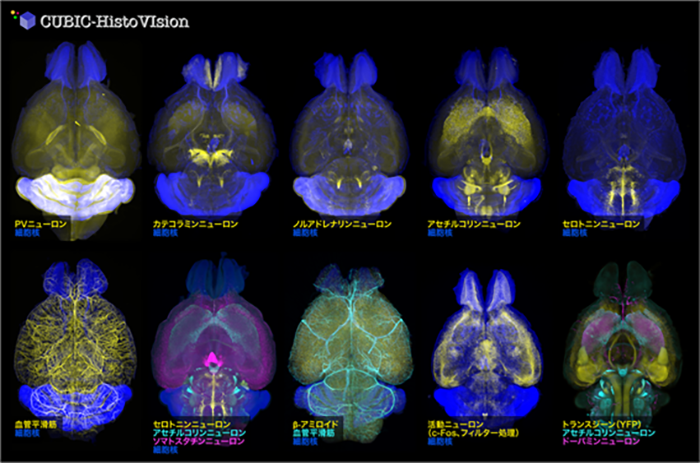
CUBIC-HVとGEMINI顕微鏡システムを活用し、約30種類の抗体や核染色剤を用いて、マウス全脳・マーモセット半脳・1cm角サイズのヒト脳病理組織を染色し、イメージングすることに成功しました。これらの実施例には、神経回路を描出する蛍光タンパク質ラベリング法[7]との組み合わせや、神経活動マーカーとして広く用いられているc-Fosタンパク質、あるいはアルツハイマー病のアミロイドタンパク質の全脳免疫染色[8]など、神経科学の研究において非常にニーズの高いアプリケーションも含まれます(図3)。また幼若マーモセット全身を細胞膜非透過型の核染色剤で丸ごと染色し3次元イメージングすることにも成功しました。
本研究で開発された3次元染色手法はこれまで発表された代表的な3次元染色法のパフォーマンスを凌駕し、現時点において世界で最も高効率な3次元組織学手法です。
今後の期待
本研究が推進した生体組織の物性解明に基づく組織化学手法のボトムアップデザインは、本分野における技術開発のパラダイムシフトになりうるものです。また、本研究で開発したCUBIC-HV法は、生体システムの構造や機能を、臓器・全身スケールでシステミックに解析する新たな手法を提供します。
今後、染色プロトコルのさらなる高速化や適用抗体・染色剤の増加により、神経科学のみならず、発生、がん、免疫・炎症、感染症などの幅広い研究分野への応用が期待できます。さらに、ヒト臨床病理学の3次元化による診断精度や客観性の大幅な向上に寄与できると考えられます。
論文情報
- タイトル
- Versatile whole-organ/body staining and imaging based on electrolyte-gel properties of biological tissues
- 著者名
- Etsuo A. Susaki*, Chika Shimizu, Akihiro Kuno, Kazuki Tainaka, Xiang Li, Kengo Nishi, Ken Morishima, Hiroaki Ono, Koji L. Ode, Yuki Saeki, Kazunari Miyamichi, Kaoru Isa, Chihiro Yokoyama, Hiroki Kitaura, Masako Ikemura, Tetsuo Ushiku, Yoshihiro Shimizu, Takashi Saito, Takaomi C. Saido, Masashi Fukayama, Hirotaka Onoe, Kazushige Touhara, Tadashi Isa, Akiyoshi Kakita, Mitsuhiro Shibayama and Hiroki R. Ueda*
*corresponding authors - 雑誌
- Nature Communications
- DOI
- 10.1038/s41467-020-15906-5
補足説明
- [1] 組織透明化技術
- 文字通り、組織をガラスのように透明にし、光学顕微鏡での内部観察を可能とする組織学的手法。古くは100年ほど前から使用されてきたが、2000年前後から急速に近代的な組織透明化法の開発が進んだ。組織透明化には組織を通過する光の散乱および吸収を解消することが重要であり、組織内の光散乱物質(主に脂質)や光吸収物質(主に色素)を除去したのち、溶媒と組織内の屈折率を均一化(屈折率調整)する操作が行われる。
- [2] 電解質ゲル
- 材料科学の分野において、ゲルは、1)メッシュ/ネットワーク構造を持つポリマーで、2)媒体に溶解せず、3)繰り返し可逆的な膨潤と収縮を繰り返す能力を持つマテリアルであると定義される。身近にあるゲルとしては、寒天や紙おむつの吸水性ポリマーがある。電解質ゲルはイオン化したポリマーで構成されたゲルを指す。本研究で固定・透明化処理を行った組織は、タンパク質(ポリペプチド)が固定剤で架橋されネットワーク構造となっており、溶液中でイオン化し、さまざまな物理化学的条件下で膨潤収縮を繰り返すことから、電解質ゲルであると結論付けられた。
- [3] CUBIC
- 組織透明化、3次元イメージング、画像解析を組み合わせた全臓器・全身全細胞解析のためのパイプライン。理研の研究チームは2014年以降、アミノアルコールを主成分とする効率的で再現性のよい透明化試薬の開発、3次元イメージングのためのライトシート顕微鏡システムの開発、多数の1細胞解像度臓器データを定量解析する方法の開発など、CUBICによる全身全細胞解析のためのツールを多数発表している。CUBICは、Clear, Unobstructed Brain/Body Imaging Cocktails and Computational analysisの略。
- [4] ライトシート顕微鏡
- レーザー光をシート上に広げて透明化サンプルの側面から照射し、サンプルの上からカメラで撮影することで、透明化サンプル内の特定の平面(光学切片)を撮影することができる顕微鏡。サンプルをZ方向に動かして光学切片を連続撮影し、高速に3次元画像を取得することができる。
- [5] 小角X線散乱法
- X線を物体に照射し、その散乱強度を散乱角の関数として測定することで、物体内部の構造を分析する手法。1ナノメートル(10億分の1メートル)から100ナノメートル程度の構造を反映する測定データが得られる。強力なX線源を必要とするため、本研究では、大型放射光施設(理化学研究所SPring-8、高エネルギー加速器研究機構フォトンファクトリー)を利用して測定を行った。
- [6] 田中豊一博士の知見を再発見
- 米国マサチューセッツ工科大学で教授を務めたゲル科学の第一人者、田中博士は、1980年代にマテリアル科学の視点からアガロースやタンパク質などの天然ポリマーを研究し、これらのポリマーが膨潤収縮挙動を示すゲルであることを明らかにした。今回、本研究チームは透明化のため固定・脱脂された組織がタンパク質主体のゲルであることを示し、田中博士らの知見を別の視点から再発見した。
- [7] 蛍光タンパク質ラベリング法
- クラゲ緑色蛍光タンパク質(GFP)をはじめとする蛍光タンパク質は、その遺伝子を人工的に実験動物に導入することにより、さまざまな細胞や解剖学的構造を蛍光によって可視化することが可能となるため、医学生命科学研究において広く用いられている。
- [8] 免疫染色
- 組織学で汎用される、組織中の特定の分子に対して特異的に結合する抗体を用い、分子や細胞を可視化する方法。可視化には酵素反応で色をつける方法や、蛍光物質を抗体に結合させる方法などがある。本研究では、蛍光イメージングにより観察を行ったため、後者の方法を採用した。
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「組織3D染色による細胞の網羅的解析技術の開発(研究代表者:洲﨑悦生)」、JST-ERATO 東原化学感覚シグナルプロジェクト(領域総括:東原和成)、日本学術振興会(JSPS)科学研究費補助金若手研究(A)「表現型責任細胞の包括的な同定を目指す次世代型マウス遺伝学の開発(研究代表者:洲﨑悦生)」、同基盤研究(A)「理想荷電性高分子ゲルの創成とその新たな応用展開(領域代表者:柴山充弘)」、同基盤研究(B)「臓器全体のタンパク質発現・修飾・活性状態の3D検出法開発(研究代表者:洲﨑悦生)」「ヒト脳組織特異的染色による先進的3D神経病理学の確立(研究代表者:田井中一貴)」、同基盤研究(S)「哺乳類生体リズム振動体の設計(研究代表者:上田泰己)」、同新学術領域(研究領域提案型)「網羅的3次元観察技術による細胞のダイバーシティー検証(研究代表者:洲﨑悦生)」「3D免疫染色によるタンパク質の老化基盤の解析(研究代表者:田井中一貴)」「組織夾雑系の理解を目的としたケミカルプローブの設計戦略(研究代表者:田井中一貴)」、同挑戦的研究(萌芽)「3次元組織中の空間的全細胞核酸解析を目指す基盤技術開発(研究代表者:洲﨑悦生)」「脳小血管病の3D病理解析基盤の確立(研究代表者:田井中一貴)」、JSPS特別研究員奨励費「レム睡眠制御を担う細胞内情報伝達分子機構の同定と解析(特別研究員:小野宏晃)」、日本医療研究開発機構(AMED) 革新的技術による脳機能ネットワークの全容解明プロジェクト「マーモセット脳の3次元観察・解析に資する基盤技術開発(領域代表者:上田泰己)」「マーモセットの眼球運動と認知機能を制御する脳領域の構造-機能マッピング研究(領域代表者:伊佐正)」、同革新的バイオ医薬品創出基盤技術開発事業「全身・臓器丸ごとイメージング技術によるバイオ医薬品の時間的・空間的な体内動態可視化技術の開発(領域代表者:上田泰己)」、同先端的バイオ創薬等基盤技術開発事業「先端的医療技術に対する全臓器・全身スケールでの評価技術基盤の開発(領域代表者:上田泰己)」、同革新的先端研究開発支援事業(AMED-CREST)「睡眠・覚醒リズムをモデルとした生体の一日の動的恒常性の解明(領域代表者:上田泰己)」、公益財団法人武田科学振興財団・ビジョナリーリサーチ助成「神経回路のグローバルな状態及びダイナミクス同定手法の開発(領域代表者:洲﨑悦生)」、同武田報彰医学研究助成「全脳イメージング技術を用いた次世代中枢薬理学の創成(領域代表者:上田泰己)」、同医学系研究助成(精神・神経・脳領域)「ヒト脳組織膨潤・透明化技術による神経病理学的解析(領域代表者:田井中一貴)」、公益財団法人日本応用酵素協会・成人病の病因・病態の解明に関する研究助成(TMFC)「全身全細胞の高速な解析を目指す組織透明化技術の開発(領域代表者:洲﨑悦生)」、平成26年度新潟大学脳研究所「脳神経病理標本資源活用の先端的共同研究拠点」共同利用・共同研究「組織透明化技術と立体組織免疫染色技術を応用したヒト疾患脳の病態解明(領域代表者:上田泰己)」、Human Frontier Science Program grant 2018 「Sleep, the clock, and the brain: a neuromathematical approach(領域代表者:上田泰己)」による支援を受けて行われました。
発表者・機関窓口
*今般の新型コロナウイルス感染症対策として、理化学研究所では全職員在宅勤務を実施しておりますので、メールにてお問い合わせ願います。
発表者
理化学研究所 生命機能科学研究センター 合成生物学研究チーム
チームリーダー 上田 泰己(うえだ ひろき)
(東京大学 大学院医学系研究科 システムズ薬理学教室 教授)
客員研究員 洲﨑 悦生(すさき えつお)
(東京大学 大学院医学系研究科 システムズ薬理学教室 准教授)
生命機能科学研究センターに関する問い合わせ
理化学研究所 生命機能科学研究センター センター長室 報道担当
川野 武弘(かわの たけひろ)
E-mail:tkawano[at]riken.jp
機関窓口
理化学研究所 広報室 報道担当
E-mail:ex-press[at]riken.jp
東京大学 医学部 総務チーム(総務担当)
TEL:03-5841-3304
E-mail:ishomu[at]m.u-tokyo.ac.jp
東京大学 物性研究所 広報担当
E-mail:press[at]issp.u-tokyo.ac.jp
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
E-mail:sentan-bio[at]amed.go.jp
シーズ開発・基盤研究事業部 革新先端開発課
革新的先端研究開発支援事業担当
E-mail:kenkyuk-ask[at]amed.go.jp
疾患基礎研究事業部 疾患基礎研究事業課
革新的技術による脳機能ネットワークの全容解明プロジェクト担当
E-mail:brain-pm[at]amed.go.jp
※上記の[at]は@に置き換えてください。
関連リンク
掲載日 令和2年4月27日
最終更新日 令和2年4月27日


