成果情報 ヒト肝胆膵・消化管神経内分泌がんを大量培養しライブラリー化 希少がん研究に突破口―がん化を決定づける因子が明らかに―
成果情報
慶應義塾大学医学部
理化学研究所
慶應義塾大学医学部坂口光洋記念講座(オルガノイド医学)の佐藤俊朗教授、川﨑健太特任助教と、理化学研究所生命医科学研究センターがんゲノム研究チームの中川英刀チームリーダーらの研究グループは、慶應義塾大学医学部内科学(消化器)、内科学(呼吸器)、外科学(一般・消化器)、薬学部薬物治療学講座、東京大学、東京医科歯科大学、国立がん研究センター中央病院との共同研究により、希少疾患のため研究が進んでいなかったヒト肝胆膵・消化管神経内分泌がん細胞を5年の歳月をかけて収集し、オルガノイドと呼ばれる技術で腫瘍細胞を大量培養することで、25系統の大規模ライブラリー(バイオバンク)作製に成功しました。
これにより包括的な分子解析が実施可能となり、全ゲノム解析をはじめとする解析を重ね、
- 神経内分泌がんでは、消化器組織に発現することが知られる転写因子の発現が正常組織と比較して低下し、通常は心筋にみられるNKX2-5と呼ばれる転写因子などが高頻度に発現している
- 神経内分泌がんは、正常細胞が成長に必要とするWntやEGFと呼ばれる増殖因子がない環境でも成長する
- 神経内分泌がん全体で染色体がダイナミックに再編成され、DNAの塩基配列以外の情報(エピゲノム)の変化によって遺伝子発現プログラム異常が起きている
などの特徴を初めて明らかにしました。
さらに研究チームは、CRISPR-Cas9と呼ばれる遺伝子編集技術を用い、正常な大腸細胞の遺伝子に神経内分泌がんで見られた変異を人工的に追加していくことで、培養した正常細胞から神経内分泌がんを新たに再構築することに成功しました。この結果、神経内分泌がんの特徴として従来いわれていたTP53、RB1の2種のがん抑制遺伝子の欠損だけでは神経内分泌がんの性質は獲得されず、NKX2-5など他の複数の因子の活性化が加わる必要があることを初めて示しました。
本研究成果は、研究材料に乏しかった神経内分泌がんについて研究の基盤となる研究リソースを提供し、希少がん研究の促進に貢献するとともに、この疾患のさらなる病態解明や創薬開発につながることが期待されます。
本研究の詳細は、2020年11月6日(米国東部時間)に科学誌『Cell』のオンライン版に掲載されました。また、2020年11月25日(米国東部時間)に科学誌『Cell』に掲載されます。
研究のポイント
- 世界で初めてヒト肝胆膵・消化管神経内分泌がんのオルガノイド大規模ライブラリー(バイオバンク)の作製に成功しました。
- 作成した試料を用いて全ゲノム解析をはじめとした包括的な分子解析を実施し、今までに不明とされてきたヒト肝胆膵・消化管神経内分泌がんの特徴的プロファイルを明らかにしました。
- 明らかにしたこのがんのプロファイルを元に、CRISPR-Cas9と呼ばれる遺伝子編集技術を用い、正常な大腸細胞の遺伝子に神経内分泌がんで見られた変異を人工的に追加していくことで、培養した正常細胞から神経内分泌がんを新たに再構築することに成功しました。
研究の背景
患者数が少なく研究が進まなかった希少がん
日本人のがん死亡数を部位別にみると、女性の1位は大腸がん、男性の1位は肺がんですが、男性の2位以降には胃、大腸、膵臓、肝臓といった消化器系のがんが続き、男女共に消化器系のがんで亡くなる方が最も多いことが知られています(厚生労働省 2019年人口動態統計の概況 第7表 死因簡単分類別にみた性別死亡数・死亡率(人口10万対))。
消化器系の悪性腫瘍は、ほとんどが腺がんまたは扁平上皮がんですが、これらとは別に、上皮構造がなく神経や内分泌細胞(注1)の特徴的なタンパク質を発現する神経内分泌がんがあります。神経内分泌がんは稀な疾患であるため希少がんに分類されていますが、予後の悪い疾患として知られ、近年は発生率が着実に増加していることから、その詳細の解明が待たれています。
研究材料に乏しくまだ謎の多い消化器系の神経内分泌がん(注2)はNECと呼ばれ、低分化型(注3)で進行が速い特徴をもっています。NECと、高分化型(注4)で比較的進行の遅い神経内分泌腫瘍(NET:注5)とをあわせて、膵・消化管(GEP)神経内分泌腫瘍(NEN)と総称されます(図1、表1)。
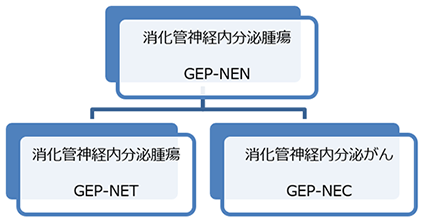
| 神経内分泌腫瘍(NET) | 神経内分泌がん(NEC) | |
|---|---|---|
| 分化型 | 高分化型 | 低分化型 |
| 病気の進行 | 遅い | 速い |
| 予後の目安 | 24か月程度 | 1か月程度 |
NETは、アップル共同設立者スティーブ・ジョブズの死因として注目を集めた腫瘍で、進行は遅いけれど最終的には遠隔転移を来す治療の難しい腫瘍です。一方、NECは非常に進行が速く、生存率が極めて低い悪性度の高いがんとして恐れられています。これらのがんは、これまで基盤となる研究モデルに乏しく、研究試料として利用可能なヒトGEP-NEN細胞株はごくわずかでした。また患者数が少ないことから臨床試験の実施も難しいため、研究が進まない状況にありました。
希少疾患を研究可能にするオルガノイド培養技術
近年、研究チームの佐藤俊朗教授らが開発したオルガノイドと呼ばれる培養技術(注6)により、患者から採取した幹細胞をもとに、3次元構造を保ったまま大量に全く同じ性質を受け継ぐクローンを増殖させることが可能になりました(Sato T, et al. Nature 2009, Sato T, et al., Gastroenterology 2011.)。そこで今回、研究チームは希少疾患に特有の課題である研究リソース不足を解消すべく、この新しい培養技術を駆使してNET3株、NEC22株のオルガノイドモデルを作成し、大規模なライブラリーを構築しました。ヒト細胞から直接培養されるオルガノイドは、元になった細胞に類似した生理的・機能的・形態的性質を有するため、候補治療薬の効果やその副作用を効率よく確認することができ、前臨床試験での動物実験を減らすことが可能とされています。
オルガノイドモデルを豊富に用いることで、希少疾患では極めて困難であった全ゲノム解析も可能となります。
研究の成果と意義・今後の展開
神経内分泌がんでは初の大規模ライブラリーを構築
本研究では、まず、ヒト神経内分泌がんの生きた臨床サンプルを5年がかりで日本国内の複数の施設より収集し、これまで研究モデルが得られていない食道、胃、十二指腸、膵臓、肝臓、胆管なども含めた消化器のNEC18株、NET3株そして肺小細胞がん4株からなる合計25株のオルガノイドモデルを樹立し、大規模にライブラリー化しました(図2)。
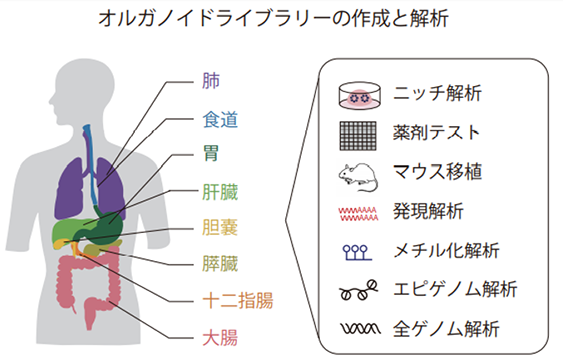
樹立したオルガノイドモデルは、その生命現象や機能を司る物質〔ゲノム、転写物(RNA)、タンパク質、代謝物など〕について網羅的に解析を行い(マルチオミクス解析)、さらにマウスへの移植を行い元の腫瘍サンプルと比較しました。その結果、全てのオルガノイド株で元の細胞の遺伝子型ならびに形態などの表現型を維持していることが確認されました。さらに、薬剤をオルガノイドに投与することによって、培養皿の中でも、NETおよびNECに対して臨床で使われる薬剤の治療効果を確認できることを初めて示しました。こうした成果から、これまで希少なために研究が困難であったNETおよびNECに対し、新しい研究基盤が確立され、研究が加速することが期待されます(図3、4)。
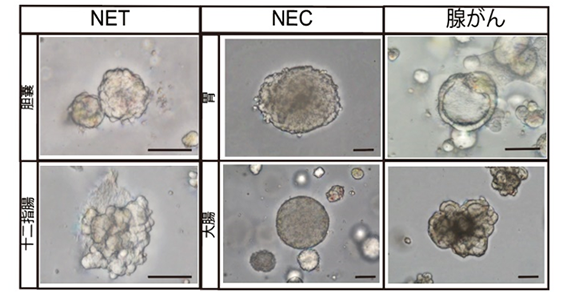
GEP-NETオルガノイドの樹立に初めて成功
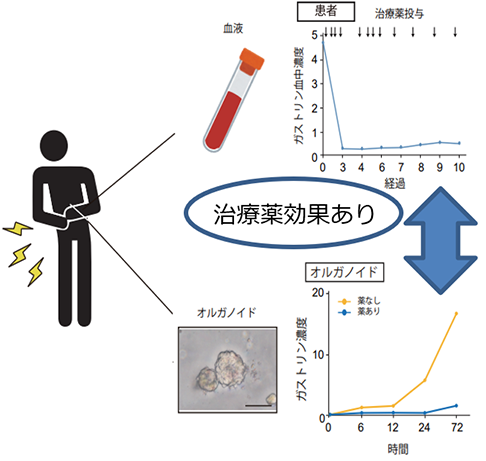
GEP-NETのオルガノイド3株は膵臓と十二指腸から採取したサンプルから樹立したもので、そのマウスへの移植片は、形質的な特徴だけでなく、ガストリンというホルモンの分泌など、親細胞の機能的特徴も継承していました。これにより、初めて試験管内で生体の機能的なガストリノーマ(ガストリンを産生する神経内分泌腫瘍)モデルの確立に成功しました(図4)。
GEP-NECの特徴的な遺伝子変異とその発生起源を同定
GEP-NECは希少疾患であるため、これまで詳細なゲノム解析はされてきませんでした。今回、樹立したGEP-NECのオルガノイドの全ゲノムシークエンス解析から、肺の小細胞がんと同様なTP53とRB1の変異が高頻度に認められることがわかりました。こうした変異パターンは通常の消化器がんには認められず、神経内分泌がんに特徴的な変異であることが確認されました。一方、通常の消化器がんとNECが併発する症例もあり、NECは通常の消化器がんから発生することが示唆されています(Mafficini and Scarpa, 2019)。研究チームは、こうした通常の大腸腫瘍(腺腫と腺がん)とNECが併発している症例で、通常の大腸腫瘍の細胞とNECの細胞からそれぞれオルガノイドを樹立し、両者の関連性を調べました。その結果、通常の大腸腫瘍にTP53とRB1の遺伝子異常が加わることでNECが発生することが裏付けられました。このように、全ゲノム解析によって体内で起きたNECの進化過程を明らかにしました。
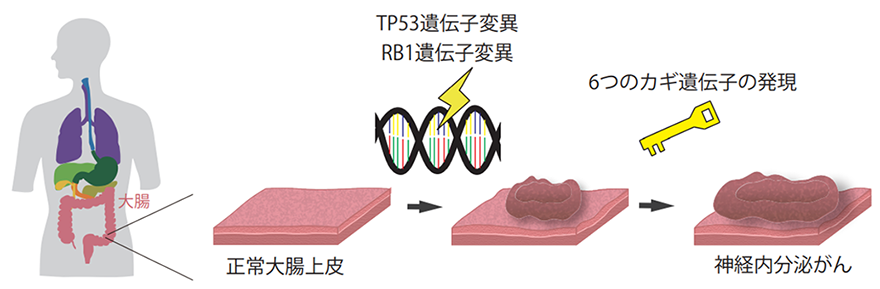
正常細胞からGEP-NEC腫瘍化に至る過程を培養皿の中で再現
次に研究チームは、上述の遺伝子変異がGEP-NECの原因となるかどうかを調べるために、正常の大腸オルガノイドのTP53遺伝子とRB1遺伝子に変異を導入し、形態の変化を調べました。しかしながら、これら2つの変異だけではGEP-NECの腫瘍とはならないことがわかりました。次に、GEP-NECの遺伝子発現を調べ、GEP-NECオルガノイドは通常の消化器がんとは異なる遺伝子発現プログラムへと書き換えが起きていること見出しました。プログラムの書き換えとは、カギとなる遺伝子の活性化によって、ある細胞が別の種類の細胞に変化する現象で、体細胞からiPS細胞を作製する過程においても用いられています。研究チームは、GEP-NECの発症に関与する6つのカギとなる遺伝子を抽出しました。これらのカギとなる遺伝子の中には、神経の発生に関わるASCL1遺伝子や心臓の発生に関わるNKX2-5遺伝子(注7)が含まれ、これらが神経内分泌腫瘍の発生に関わることが示唆されました。さらに、TP53とRB1変異とともにこの6つのカギとなる遺伝子を導入することにより、正常の大腸オルガノイドからGEP-NECが発生することを実証しました。これらの結果から、正常の消化器からどのように通常型の腫瘍ができ、さらに稀なGEP-NECがいかにして発生するかに至るまで、腫瘍発生メカニズムの理解を深めました(図5)。
GEP-NENは増殖因子がなくても育つことを発見
体細胞のほとんどは、勝手に増殖しないように、EGFやWntなどの“増殖因子”と呼ばれる刺激がないと増殖しないようプログラムされています。多くのがんは、遺伝子変異によってこうした制御機構が破綻し、異常に増殖することを特徴とします。一方、本研究で樹立されたGEP-NENオルガノイドの多くは、このような遺伝子変異を伴わない増殖因子非依存性の増殖を示しました。さらに、研究チームは、こうした増殖因子非依存性の増殖は、細胞プログラム書き換えに関わる6つのカギとなる遺伝子の発現によって可能となることを見出しました。従って、GEP-NENオルガノイドは遺伝子変異だけではなく、プログラム書き換えによって、増殖因子がなくても増殖することがわかりました。このことから、近年のがん治療で注目されている増殖因子を標的とした治療は、GEP-NENに対しては効果が限定的であることが示唆されました。一方、GEP-NECオルガノイドは臨床で同疾患に使われるシスプラチンという薬剤に対しては感受性を示し、現在使われている治療薬の有効性が裏付けられました。
今後の展開
本研究では、GEP-NENオルガノイドライブラリーの包括的なプロファイリングにより、GEP-NENの分子パターンと独特な生物学的表現型を結びつけることに成功し、希少がんに対するオルガノイドベースのアプローチの有効性が示されました。更に、オルガノイドの包括的解析を通して、NECの発生機構に関与する可能性のある遺伝子変異やNECの特徴と考えられる知見を探索し、その結果を踏まえて正常な大腸細胞オルガノイドに遺伝子編集を加え、正常細胞ががん化しNECとなる過程の再現に成功しました。本研究で構築されたライブラリーは、世界の研究コミュニティーが活用することで、悪性度の高いNECへの治療薬開発や、神経内分泌腫瘍全般のさらなる発生機構の解明へのブレークスルーとなることが期待されます。また、オルガノイドを用いた研究戦略は、今後の希少疾患研究の基盤となり、さらなる医療の発展をもたらす可能性を秘めていると考えられます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業「がん多階層フェノタイプの理解に基づいた先端的創薬システムの開発」、次世代がん医療創生研究事業「肺がんオルガノイドライブラリーを用いたprecision medicineの確立と新規治療標的の同定」、革新的がん医療実用化研究事業「肺がんオルガノイドを用いた治療後期肺がんの悪性度の本態解明」、革新的先端研究開発支援事業「新しい4次元モデルシステムを用いた腸管線維化疾患の病態解明」、老化メカニズムの解明・制御プロジェクト個体・臓器老化研究拠点「消化器組疾患発症制御を目指した加齢形質変化の理解」、JSPS科研費JP17H06176の支援によって行われました。
論文
- 英文タイトル
- An Organoid Biobank of Human Neuroendocrine Neoplasms Enables Genotype-Phenotype Mapping
- タイトル和訳
- ヒト神経内分泌腫瘍のオルガノイドバイオバンクの確立によって、遺伝子変異の腫瘍悪性化への関わりを明らかにした
- 著者
- 川﨑健太、利光孝太、股野麻未、藤田征志、藤井正幸、戸ヶ崎和博、胡谷俊樹、下川真理子、高野愛、高橋シリラット、太田悠木、南木康作、五十嵐亮、石丸和寛、石田洋樹、須河恭敬、杉本真也、齋藤義正、前嶋和紘、笹川翔太、Hwajin Lee、Hong-Gee Kim、Kyungsik Ha、浜本純子、福永興壱、前川彩、田邉稔、石原聡一郎、浜本康夫、安田浩之、関根茂樹、工藤篤、北川雄光、金井隆典、中川英刀、佐藤俊朗
- 掲載誌
- Cell
- DOI
- 10.1016/j.cell.2020.10.023
用語解説
- (注1)内分泌細胞
- 胃や大腸等の正常の消化器の臓器でも認められる細胞で、ホルモンやペプチドを分泌して、消化管の運動等をコントロールしている。
- (注2)神経内分泌がん
- がんの中でも神経内分泌のマーカーが認められる珍しいタイプのがん。罹患率は10万人に0.5人~1人とされるが、近年増加傾向にある。進行が速いことが特徴である。
- (注3)低分化
- 元の細胞の組織構築が維持できていない状態をいう。
- (注4)高分化
- 元の臓器の組織構築を保っている状態をいう。
- (注5)神経内分泌腫瘍
- 以前はその遅い病状の進行から“がんもどき”とも呼ばれた神経内分泌のマーカーの発現する腫瘍だが、転移も起こし、これで死に至るため、その認識が改められている。進行が遅いことが特徴である。
- (注6)オルガノイド培養技術
- 患者から得られた少ない量の組織サンプルで3次元的に上皮細胞を構造体として長期間にわたって増殖させることができる技術である。
- (注7)NKX2-5
- 心臓の発生に大きく関わりのある遺伝子で、通常大腸等では認められない。
お問い合わせ先
本発表資料/研究に関するお問い合わせ先
慶應義塾大学医学部 坂口光洋記念講座(オルガノイド医学)
教授 佐藤俊朗(さとうとしろう)
TEL:03-5363-3063 FAX:03-3353-6247
E-mail:t.sato”AT”keio.jp
慶應義塾大学坂口光洋記念講座(オルガノイド医学) | ヒト疾患生物学を創出する−オルガノイド医学
理化学研究所 広報室 報道担当
E-mail:ex-press”AT”riken.jp
本リリースの配信元
慶應義塾大学信濃町キャンパス総務課:山崎・飯塚
〒160-8582 東京都新宿区信濃町35
TEL:03-5363-3611 FAX:03-5363-3612
E-mail:med-koho“AT”adst.keio.ac.jp
慶應義塾大学医学部・医学研究科
AMEDに関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2311 FAX:03-6870-2244
E-mail:cancer“AT”amed.go.jp
※E-mailは上記アドレス“AT”の部分を@に変えてください。
掲載日 令和2年11月25日
最終更新日 令和2年11月25日


