アーカイブ ゲノム解析とデータベースを駆使して、パーキンソン病を真の意味で治療する

上中 健
神戸大学大学院医学研究科 神経内科学 医師
日本人の1000人に約1人、60歳以上では100人に約1人が罹患するパーキンソン病。この疾患は、脳内のドパミン神経細胞が減少してドパミン産生量が低下することで、安静時振戦、筋固縮、無動・寡動、姿勢反射障害などの症状を呈することを特徴とする。現在では多くの薬あるいは手術によって症状を緩和することができる。しかし、どの治療法も対症療法に過ぎず、病勢の進行そのものを止めたり、根本的に治療したりすることの実現には未だ至っていない。H28~32年度 ゲノム医療実現推進プラットフォーム事業「パーキンソン病に対する真の意味のオーダーメイド治療を目指した研究」(研究開発担当者:東京大学大学院医学系研究科 戸田 達史)では、ゲノム解析を通じた治療最適化、創薬を目指している。
戸田先生のもとで研究をしている、神戸大学大学院医学研究科の上中 健先生。現在は大学院博士課程に所属しながら、神経内科医としての診療を続けている。医師になったきっかけを「父が腹部外科の開業医で、救急でよく呼び出されていたのですが、お世話になった親戚たちから『父に助けてもらった』という話を聞いて、医者が格好いいと思ったのでしょうね」と答えた。多くの診療科の中から神経内科の道に進んだ理由は、脳のことが一番解明されていないと感じたからだった。「自分の人生を賭ける価値があると思ったのです」(上中先生)。
「パーキンソン病を治したいのだよ」に触発されて
神経内科における変性疾患で、アルツハイマー病に次いで多いのが、パーキンソン病だ。上中先生も、パーキンソン病患者を多く診てきた。パーキンソン病は、症状を緩和する薬が比較的多い。これらの薬の機序を理解して患者に適切に届けるためには、基礎研究の理解が必要不可欠だろうと考えた上中先生は大学院に進学し、そこで指導教員である戸田先生と出会った。
当初、上中先生は、基礎研究に対して「細胞やマウスを使って実験をする」という漠然としたイメージしか持っていなかった。ところが戸田先生の「パーキンソン病を治したいのだよ」という言葉に、自身の考えを反省させられたという。「正直、最初は戸田先生の言葉の真意が理解できませんでした。なぜなら、パーキンソン病に対する薬は多くあり、実際に私も処方してきたので、今さら『治す』とはどういうことだろうと思ってしまったのです。しかしよく考えると、現状の治療では症状を抑える対症療法が限界であり、根本治療するものではありません。戸田先生は、パーキンソン病の原因を突き止め、進行を止めたり根本的に治療したりすることを目指しているのです」と、当時の考えを振り返る。これが、研究開発課題名である「パーキンソン病に対する真の意味のオーダーメイド治療を目指した研究」の意味だ。
その戸田先生の言葉に触発され、上中先生はパーキンソン病の根本治療につながる研究に取り組むことになった。
in silico薬剤スクリーニングで新規治療薬候補を発見

2018年に戸田先生・上中先生らは、パーキンソン病の新たな治療薬候補をin silico薬剤スクリーニングによって見出すことに成功している(推薦論文1)。それは現在、悪性黒色腫に対して使用されている薬剤「ダブラフェニブ」である。ダブラフェニブに至るまで、「パーキンソン病発症に関わるリスク遺伝子は、ゲノムワイド関連解析(Genome-Wide Association Study:GWAS)により複数同定されていました。ただ、この知見をどう活用すれば疾患治療に結びつけることができるのかが課題でした」と上中先生は振り返る。
そこで、大阪大学大学院医学系研究科の岡田 随象先生らが開発した薬剤スクリーニング手法に着目した。岡田先生らは関節リウマチにおいて、GWASの結果を、たんぱく質間相互作用のデータベースおよび薬剤データベースと組み合わせ、すでに乳がんなどの治療で使用されている薬剤を関節リウマチの新たな治療薬候補として同定することに2014年に成功していた(推薦論文2)。「タンパク質間相互作用のネットワークを介して、薬剤データベースに登録されている遺伝子とリスク遺伝子をつなげることで、他疾患で使用実績のある薬剤をスクリーニングできます。関節リウマチで成功したこの手法をパーキンソン病でも当てはめることができないかと戸田先生が考えたようです」(上中先生)。使用実績のある薬剤を別の疾患に適応することは「ドラッグ・リポジショニング」と呼ばれており、治療薬の開発期間やコストの短縮につながるとして近年注目されている。
そこで上中先生らが、パーキンソン病のリスク遺伝子について同じ手法で解析したところ、米国食品医薬品局(FDA)に承認されている57薬剤が同定された。このうち17薬剤(約3割)はin vivoまたはin vitroのパーキンソン病モデルで神経保護作用を有する報告がすでにあったことから、上中先生は「この手法でかなり効率よく絞り込みができた」と手応えを感じたという。新規に同定された残り40薬剤のうち、培養細胞やマウスに神経毒を投与したパーキンソン病モデルを用いて効果を検証した結果、最も効果的だったのが悪性黒色腫の治療薬ダブラフェニブだった。「MPTPという神経毒はパーキンソン病様の病態を引き起こします。MPTPを投与したマウスではドパミン神経が脱落するのですが、MPTP投与前にダブラフェニブを脳室内投与するとドパミン神経細胞死が抑制されることがわかりました」(上中先生)。
実は、悪性黒色腫のある人はパーキンソン病に数倍なりやすいという疫学研究がある。ただ、悪性黒色腫は白人に多く、日本人ではまれな疾患であるため、国内ではあまり注目されてこなかった。また、現在のダブラフェニブの適応は、BRAF遺伝子変異を有する根治切除不能な(かなり進行した)悪性黒色腫に対してであるため、パーキンソン病への使用につなげようとする発想が生まれにくかったかもしれない。In silico解析ならではの成果と言える。
また、このようなデータベースを活用した解析は、既存の薬剤全てを調べるよりも効率よく治療薬候補をスクリーニングできるだろう。パーキンソン病のみならず、すでにGWASが行われている種々の疾患、例えばアルツハイマー病や筋萎縮性側索硬化症(ALS)といった神経疾患にとどまらず、糖尿病や高血圧症などにも活用できる可能性があると、上中先生は期待している。
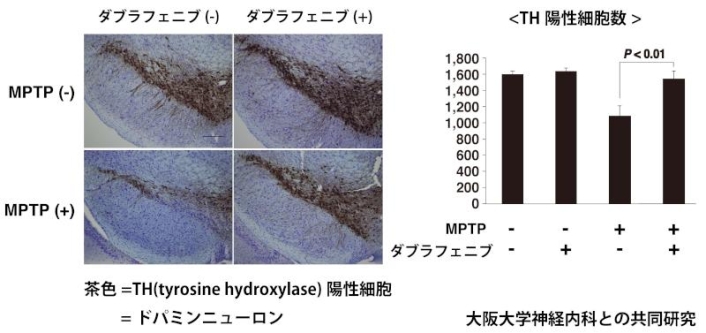 図1:マウス脳切片(冠状断)のTH(チロシン脱水素酵素)免疫染色
図1:マウス脳切片(冠状断)のTH(チロシン脱水素酵素)免疫染色神経毒(MPTP)によりマウスのTH陽性細胞(ドパミンニューロン)が脱落するが、
ダブラフェニブを投与したマウスではドパミンニューロン細胞死が抑制された。
同じ背景で検証できるのが基礎研究の面白さ
これでパーキンソン病の根本治療への道筋が見えたわけではない。もちろん臨床の現場にもっていくためには臨床試験を行う必要があるが、それ以前に課題はいくつもあるという。「例えば、今回のマウス実験ではダブラフェニブを脳室内投与していますが、患者にとっては内服などの非侵襲または低侵襲な方法のほうが好ましいはず。別の投与方法でも同様の効果があるのか検証したいと考えています。また、今回はパーキンソン病モデルとして神経毒MPTP投与マウスで検証しましたが、パーキンソン病の発症につながる遺伝子を過剰発現させるモデルもあります。ヒトへの応用は、別のモデルマウスでも同様の効果が得られるか検証してから考えるべきだと思います」(上中先生)。
こういった検証の積み重ねは基礎研究ならではの面白さだと、上中先生は言う。ヒトを対象とする試験ではどうしても個人差の影響を受けてしまう難しさがある。一方で、細胞やマウスは遺伝的背景が同じなので、得られるデータをより科学的に解釈できる。そのような点で、細胞やマウスを用いる研究に価値があると話す。
これらの研究と並行して、この研究開発課題ではオーダーメイド治療法の確立や早期診断を試みている。具体的には、孤発性パーキンソン病患者のエクソーム解析、薬剤感受性一塩基多型(Single Nucleotide Polymorphism:SNPs)による副作用・効能予測、バイオーカーによる早期診断の研究が行われている。特に早期診断に関しては、早期治療の観点からも重要になるだろうと、上中先生は考えている。進行してからの治療が難しいのは、どの疾患でも同じだ。早期発見は、患者にとってショックなことだが、もし根本的な治療法を確立できれば、「早くわかってよかった」と言えるようになるのかもしれない。そのためには、病態解明といった基礎研究から、バイオマーカー探索、コンパニオン診断薬の開発、そして治療法の確立といった応用研究が1つのプロジェクトのもと、同時並行で実施されることが欠かせない。
「もう治せない」から「いつか治せるだろう」へ

神経内科の領域においてこの10年間で根本的治療薬が新たに開発された例は多くない。病状が進行する患者を診ていて心の中で諦めを感じる自分がいたという。「ところが、今の研究を進めていくにつれて、こういった神経疾患もいつか治せるだろうと思うようになってきました。自分の心持ちや、もしかしたら患者さんとの接し方も変わってきたのかもしれませんね」(上中先生)。
博士号を取得後も、基礎研究と臨床医を両立したいと考えている上中先生。患者と直に対面することが研究へのモチベーションに繋がると感じているからだ。「根本的な治療を目指した研究が行われていることを、多くの医師に認識してほしいです。そして、治療薬の開発やバイオマーカーの探索など、研究に関わる人が一人でも増えてほしいと願っています」と最後に呼びかけた。
インタビュー動画
- コラム研究者紹介(youtube動画)
推薦論文
雑誌名 Human Molecular Genetics
号、発行年 22 August 2018
雑誌名 Nature volume
号、発行年 506, pages 376–381 (20 February 2014)
研究者経歴
1982年、兵庫県生まれ。2007年3月に神戸大学医学部 卒業。現在、同大学大学院医学研究科 博士課程に在籍。2012年4月から現職。専門分野は、臨床神経学、パーキンソン病。
掲載日 平成31年3月7日
最終更新日 令和2年3月30日


