アーカイブ 検査体制の構築も医療― 国立がん研究センター中央病院が推進する、がん関連多遺伝子パネル検査

角南 久仁子
国立がん研究センター中央病院 病理・臨床検査科 医員
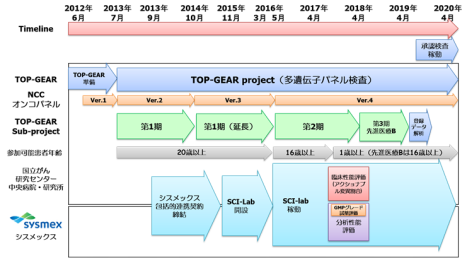
がんの治療における抗がん剤の選択は、従来は部位別であったが、近年ではがん細胞における遺伝子変異を調べて遺伝子変異別に行われることが増えてきた。国立がん研究センター中央病院では、「がん関連多遺伝子パネル検査(NCCオンコパネル)」の開発と実施を進めるプロジェクト「TOP-GEAR(Trial of Onco-Panel for Gene-profiling to Estimate both Adverse events and Response) 」が2013年から行われている。目指すは、個々の患者ごとの遺伝子変異に基づいた「個別化治療」だ。

ではなく腫瘍内科医を
バックグラウンドとする
角南先生。
TOP-GEARプロジェクトのメンバーの一人で、クリニカルシークエンスの体制づくりや医師向けレポートの作成を担当しているのが角南 久仁子先生だ。TOP-GEARプロジェクトが始まった2013年当時は呼吸器内科でチーフレジデント(2年間の研修のがん専門修練医)として勤務していたが、翌年にはTOP-GEARのパネル開発に携わる国立がん研究センター研究所ゲノム生物学研究分野の河野 隆志先生のもとで研修生としてトランスレーショナルリサーチを開始し、2015年からNCCオンコパネル開発チームの正式なメンバーとして参加している。
実臨床での利活用が前提のNCCオンコパネル
「私が所属していた呼吸器内科では肺がんを診ることが多くあるのですが、肺がんではがんの発症や治療に直結するドライバー遺伝子が多く見つかっています。変異する遺伝子の種類によって治療効果が劇的に変わる症例を多く診てきたので、遺伝子変異に基づいた個別化治療を研究テーマとするラボに行きたいと思うようになりました。そこで、RET融合遺伝子(肺腺がんの2%に存在する遺伝子変異)を発見した河野先生のもとで研究したいとお願いしました」(角南先生)。
がんの発症に関与する遺伝子を網羅的に解析する遺伝子パネルの多くは研究段階だが、TOP-GEARプロジェクトにおける国立がん研究センターが開発した日本人の特徴を踏また試薬「NCCオンコパネル(図1)」は、実臨床にもつなげることを目標としている。角南先生は、「臨床で活用するにあたっては、検査結果の品質保証に気を遣う必要があります」と話す。こうして集められたデータは、平成28~30年度 臨床ゲノム情報統合データベース整備事業 「ゲノム創薬・医療を指向した全国規模の進行固形がん、及び、遺伝性腫瘍臨床ゲノムデータストレージの構築」(研究開発代表者:国立がん研究センター 中釜 斉)に用いられる。
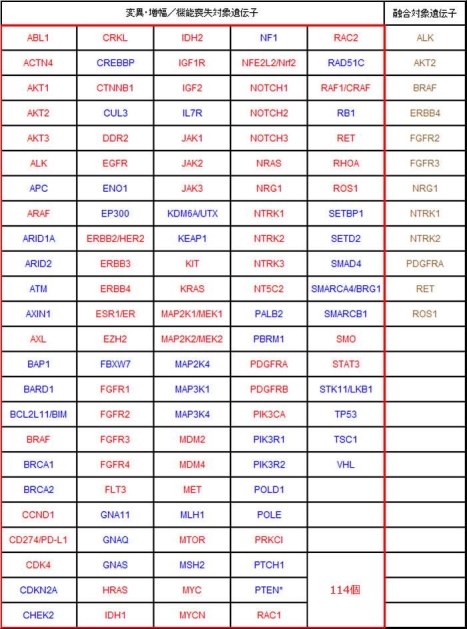
図1:「NCCオンコパネル」に搭載されている遺伝子は114個。遺伝子異常によって機能が活性化した場合に意義がある遺伝子と、機能が欠失した場合に意義がある遺伝子に分けられる。赤字は、活性化遺伝子異常を認めた場合に治療方針決定の補助となりうる遺伝子、青字は、機能喪失遺伝子異常を認めた場合に治療方針決定の補助となりうる遺伝子。また、114個の遺伝子のうち、12個については、治療方針決定の補助となりうる融合遺伝子(茶色)についても調べる。
(出典:国立がん研究センター中央病院 Webサイト より図および一部文章を抜粋
2018年度から先進医療Bの枠組みで開始
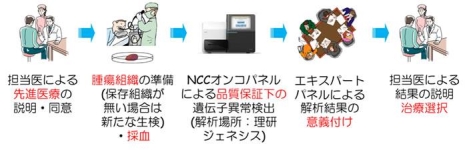
NCCオンコパネルを用いた遺伝子検査は、2018年度からは先進医療Bとしても患者への提供が始まった。検査では、患者へのインフォームドコンセント(IC)を行った上で、提供された遺伝子解析する腫瘍組織と、これと比較するための血液を元に、114個の遺伝子の変異・増幅、うち12個については遺伝子の融合を調べる(図2)。検査には数週間、遺伝子解析結果を担当医を通じて患者へ結果を戻すまでには1カ月弱を要するが、1回の検査で、日本人に合った がんに関連するたくさんの遺伝子変異を調べられることは、大きなメリットだ。先進医療Bとして検査を受けられるのは16歳以上で悪性固形腫瘍の診断があるなどの条件があるが、16歳未満でもTOP-GEARプロジェクト内の臨床研究として参加できるという(図3)。「TOP-GEARプロジェクトを進める中で、小児科の先生からも強い要望が上がっていました。そこで2017年11月からは1歳以上の小児も、臨床研究として検査を受けられる体制にしました」(角南先生)。
また、NCCオンコパネルでは、腫瘍細胞と正常細胞をペアで解析するため、生殖細胞系列の遺伝子変異かどうかも判断できる。生殖細胞系列の変異が検出された場合、患者本人のがん再発のリスクのみならず、場合によっては家族のがん発症のリスクにも関わる。そのときには、患者や家族への遺伝カウンセリングの体制も含めたフォローが必要となる。解決すべき課題は増えるが、角南先生は、「例えば、生殖細胞系列におけるTP53遺伝子の変異が主な原因とされるリ・フラウメニ(Li-Fraumeni)症候群と診断された場合、多発性に原発がんを発症しやすくなるため、丁寧にフォローアップしようと呼びかけることができます。また、リ・フラウメニ症候群では、放射線による二次性悪性腫瘍の合併が懸念されるため、X線検査や放射線治療を回避しようと提案できます」と、生殖細胞系列を検査するメリットを強調する。
専門医が協議するエキスパートパネルの標準化に取り組む

写真2:エキスパートパネル
での議論の様子。
NCCオンコパネルによる解析結果は、「エキスパートパネル」という複数の専門医による協議の場で「意義付け」がされた後、担当医が患者に結果を説明する。エキスパートパネルにおける協議に必要なデータをまとめるのも、角南先生の業務の1つだ。このエキスパートパネルには、認定遺伝カウンセラーや臨床遺伝専門医も参加して、前述した生殖細胞系列における遺伝子変異が認められた場合の患者をどうフォローするかも話し合われる。
ただし、エキスパートパネルの運用についてはマニュアルがあるわけではなく、むしろモデルケースとなるような体制構築の段階であると、角南先生は言う。現在、がんゲノム医療を提供する中核拠点病院は国立がん研究センターを含めて全国で11拠点あり、その中でも国立がん研究センターは2013年という比較的早い段階からエキスパートパネルを運用している。全国の拠点病院に向けてエキスパートパネル運用についての情報を発信するだけでなく、他の拠点病院のエキスパートパネルにも参加して、よいところを取り入れられれば、と話す。
さらに今後は、エキスパートパネルも含めたクリニカルシークエンスの標準化が課題になると、角南先生は指摘する。(現状の国立がん研究センター中央病院のクリニカルシークエンス運営体制については、図4を参照)エキスパートパネルに参加する医師の構成や審議手順、検体の品質管理、患者へのインフォームドコンセント、文書などの標準化が、がんパネルが保険適用となる際には重要になるだろうと見通している。医師の構成については、臨床医だけでなく、分子生物学の知識をもつ人材も求められるとしている。当然ながら、解析結果に対する分析的妥当性・臨床的妥当性・臨床的有用性に関する評価をする際のエビデンスレベルの標準化も必要だ。角南先生は、がんゲノム医療中核拠点病院等連絡会議の下に設置されている「エキスパートパネル標準化ワーキンググループ」に参加して、標準化に向けた取り組みも行っている。(参考資料1、③参照)
日本独自のデータベースを作り、予後予測や創薬への活用に期待
NCCオンコパネルによる検査結果が抗がん剤の選択に役立つ一方、遺伝子に異常が見つからない場合や、異常が見つかっても治療に使用できる薬剤がない場合もある。これまでNCCオンコパネルの検査を受け、レポートを渡すことができた患者は、2018年3月までに約600例。そのうち、フォローアップが行われ、正確に集計がとれた187例のうち、実際に治療選択に役立つ遺伝子変異が見つかって変異に基づく治療が行われたのは25例と、約13%だ。米国などで行われている同様のがんパネル検査とほぼ同等の成績だが、患者への説明には慎重にならざるをえないという。「患者は、検査を受ければ絶対に治療法が見つかると、どうしても期待してしまいます。過剰な期待をもたれてしまうと、遺伝子変異が検出されなかったり、治療につながらなかったりしたときに失望につながりかねません。事前に担当医が、検査には限界があることも含めて正しく情報を提供するようにしています」(角南先生)。
治療選択につながる成績を改善する方法は2つあると、角南先生は考える。1つは、治験情報のデータベース化だ。特に企業が行う治験はオープンにならない情報が多くあり、そこに患者をどう誘導するかが問題となる。もう1つは、ゲノム解析を用いたがん治療データの蓄積だ。がんゲノムの情報と、実際に患者に行われた治療と効果を全国から集計できれば、新たな治療の選択肢を提供できるかもしれない。後者は、AMEDの「臨床ゲノム情報データストレージの整備事業」が目指すことでもある。角南先生は、「現在がんパネルに求められていることは遺伝子変異の検出と治療選択ですが、データが集まれば、診断だけでなく予後予測や創薬にも活用できると考えられます」と期待を寄せる。
実は、データの集めやすさという点においては、がんパネル検査が先攻するアメリカよりも、国民皆保険制度のある日本のほうが有利だという。保険収載できるようになれば、データを一箇所に集約できるからだ。また、人種によってがん発症の傾向は異なることも見逃せない。例えば肺がんの場合、日本人ではEGFR遺伝子の変異が多く見つかるが、海外ではKRAS遺伝子の変異が多いという。こうした違いから、日本独自のデータベースを作ることが必要だと、角南先生は考えている。
コミュニケーションを大切にして、間接的にがん治療に関わりたい
TOP-GEARプロジェクトを進める上で、角南先生が重視するのはコミュニケーションだ。もともと人と接するのが好きで、患者はもちろんのこと、看護師などとのコミュニケーションも大切にしていたという。現在では、バックグラウンドが大きく異なる研究者や医師、企業の担当者と一緒に仕事することが多く、言葉の伝え方や受け止め方により一層気を配る。角南先生は、「エキスパートパネルなど、新しい体制を構築するときは、さまざまな立場の人が集まります。その中でコミュニケーションを上手く取ることで、新しいアイデアや意見が出てくると思っています。今の私の仕事だけでなく、共同研究などにも当てはまることではないでしょうか」と語る。
プライベートでは毎日の家事・育児に励む。家事は機械による全自動化や家事代行へのアウトソーシングを積極的に行い、ほぼ100%を子どもと向き合う時間に当てているという。「夫との連携が重要です。連絡を密に取ったり、やって欲しいことはお互い具体的な指示出しを心がけています。仕事も家庭も、"タスクに対するチームプレー"が大事だと思います」と笑顔を見せた。
5年前にチーフレジデントとして国立がん研究センターに来た時には現在の仕事は想像できなかったものの、NCCオンコパネルに興味を持って飛び込んだ事が今のライフワークにつながっているのが面白いと、角南先生は振り返る。「患者を診るだけが医療ではなく、エキスパートパネルの体制構築(図4)や運用なども、立派な医療だと考えています。このような間接的な方法で、今後もがん治療に関わっていきたいと思います」と、これからのゲノム医療と自身のキャリアを展望した。
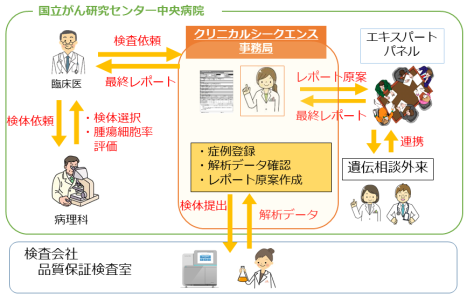
図4:国立がん研究センター中央病院のクリニカルシークエンス運営体制。
クリニカルシークエンスの事務局として各方面と連携体制を取っている
インタビュー動画
- コラム研究者紹介(youtube動画)
推薦論文
雑誌名 Nature Medicine
号、発行年 2017 Jun;23(6):703-713
研究者経歴
1982年、神奈川県生まれ。2007年 横浜市立大医学部卒業。 横浜労災病院 初期臨床研修医、および、都立駒込病院 内科 後期研修終了後、2013年4月より国立がん研究センター中央病院 呼吸器内科のがん専門修練医として勤務しながら、同研究所ゲノム生物学研究分野でゲノム解析を学んだことを機に、クリニカルシークエンスプロジェクトに参画。2015年7月より現職。国立がん研究センター中央病院におけるクリニカルシークエンスプロジェクトであるTOP-GEARの実務者としてゲノム医療実現に向けて取り組む。専門分野は、臨床腫瘍学、遺伝子診断学。
関連リンク
掲載日 平成30年11月26日
最終更新日 令和2年3月30日