アーカイブ ケミカルバイオロジーで挑む遺伝病が引き起こすRNAスプライシング異常の機構解明と創薬

網代 将彦
京都大学大学院医学研究科 特定助教
遺伝病は酵素やイオンチャネルなど、さまざまな遺伝子の異常により引き起こされ、ヒトでは単一遺伝病だけでも約6000種に及ぶ。これに対して、RNAの機能やプロセシングの異常は遺伝病との関連が深く、遺伝病のうち約35%がRNAスプライシングの異常によると見積もられている。
H28~30年度 ゲノム創薬基盤推進研究事業「スプライシング操作化合物を対象としたファーマコゲノミクス解析に基づく遺伝性難病治療薬の開発研究」(研究代表:京都大学大学院医学研究科 萩原 正敏)では、生物学と有機化学を組み合わせるケミカルバイオロジーを用いて、RNAスプライシング変異の化合物応答を体系的に理解し、創薬につなげようとしている。その先陣を、同研究科 創薬医学講座で担うのが、網代 将彦 先生だ。
RNAスプライシングは、転写後のmRNA前駆体からイントロンを取り除き、エクソン同士をつなぎ合わせるプロセス。RNAスプライシングの後、成熟したmRNAが核外に出てリボソームに輸送され、タンパク質に翻訳される。
この過程では、エクソンが恒常的にスプライシングされる場合だけでなく、特定のエクソン配列(またはイントロン配列)の認識が組織や細胞系譜によって一定の割合で制御されている場合もある。これを「選択的 (alternative) スプライシング」と呼んでいる。この選択的スプライシングは、単一の遺伝子から異なったmRNA、そしてタンパク質を生み出す仕組みであり、生物の進化、多様性を導く要因の1つとして考えられている。
近年、NGS(Next Generation Sequencer:次世代シークエンサー)の進歩などによって深部イントロンの解析やロングリードが可能になったことから、RNAスプライシングの機構解明が進み、その機能や関連する変異の重要性が注目されている。
RNAスプライシング変異に応答する低分子化合物で
希少疾患の標準治療を塗り替える
この研究プロジェクトで研究対象とする疾患を選考する基準は、RNAの配列、どのようなスプライシング異常が起きるか、その配列のパターンをもとに検討してる。そこから、まず法則性の抽出等を目指している。薬の候補もマッチングしながら、系統立てて整理するというイメージだ。そのためには、疾患そのものの知識だけでなく、薬の知識も必要になる。どういった方向に研究が進んでいくかによって、さまざまな方面の勉強を続けていかなければならない。新しいアプローチであるゆえ一つ一つの実施例を積み上げることはチャレンジの連続でもある。
「通常は、イントロン領域であるにも関わらず、ある遺伝子変異が生じたためにスプライシング調節領域が新しく作り出されることがあります。これにより、イントロン領域の一部がエクソンとして認識され、遺伝子疾患の原因となっていることも実際に数多くあります」。複雑な機構全体を見ながら、一方で個々のRNAスプライシング変異も見ていく必要があると網代先生は語る。このように、研究のやりがいと難しさに日々向き合っているのだ。
網代先生が在籍する創薬医学講座や、その支援講座である萩原先生の形態形成機構学教室では、これらのRNAスプライシングの異常の検出、それを変化させる化合物の探索、そして、化合物による異常を修復する効果の検証という一連の流れで、その評価系を同時並行的に開発しながら研究している(図1)。そしてまた、RNAスプライシングの異常発生パターンや化合物のライブラリも構築している。このように化合物の側から生命現象を明らかにしていくのはケミカルバイオロジーならではの手法で、創薬に結びつきやすいという特徴がある。
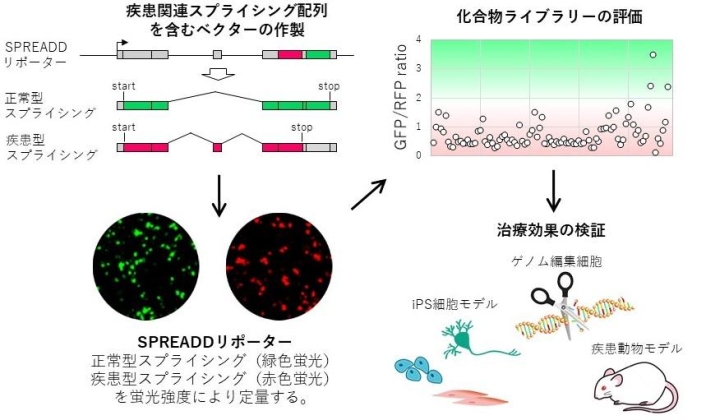
図1:RNAスプライシング異常に関連する遺伝病の解明と、治療薬の創出に挑むケミカルバイオロジーのアプローチ
網代先生らが現在対象としているそれぞれの疾患をもつ患者数は、少ないものでは全世界で100~200人、多い方で2,000~3,000人、平均500人前後。その治療薬はオーファンドラッグとなり、製薬企業が開発に取り組まないことがほとんどだ。対症療法だけで治療法がないに等しい疾患も多い。
一部の遺伝病では特定の原因遺伝子産物の補填や活性化が行われており、例えば、組み換えタンパク質による酵素補充療法の血中投与、点滴、髄腔内投与が1990年代からスタンダードになっている。
運動神経細胞が障害され、筋萎縮が生じる脊髄性筋萎縮症(SMA:spinal muscular atrophy)では、アンチセンス薬のヌシネルセンが2016年にFDA、2017年には日本でも保険承認された。これは、RNAスプライシングの制御を標的とした世界初の薬剤で、効果が高い一方、対象患者数が少ないこともあり日本での薬価は数千万円と高額だ。
ただ、このヌシネルセンを含め、組み換えタンパク質やアンチセンスによるマクロ分子薬は組織への送達が難しく、疾患や治療効果に限界があるため、低分子治療薬の開発が複数進んでいる。
AMEDが支援するこの課題で現在研究・開発中のRNAスプライシング変異に応答する低分子化合物は、世界初の新しい戦略であり、ある疾患における標準治療を塗り替える成果が得られる可能性がある。また、患者数が少ない弧発性の疾患でもRNAスプライシング異常のパターンがわかれば治療薬とマッチングする可能性も高まり、応用範囲は広い。
蛍光強度で遺伝子変異を観察するSPREADDリポーターシステムを活用
網代先生が担当しているのは、一連の研究のスタートとなる、標的候補とすべきRNAスプライシング変異の選択だ。疾患変異データベース等に登録されている、RNAスプライシングとの関連が予測される遺伝子変異から、化合物等で効果が見込める可能性のあるものを選び出す。そして、萩原研究室が開発したRNAスプライシングの検出系であるSPREADD(splicing reporter assay for disease genes with dual color)リポーターシステムを使い、より詳細に遺伝子変異を調べていく。
SPREADDリポーターシステムでは、RNAスプライシングで特定のエクソンが脱落したり挿入されることによって、あらかじめ決めておいた塩基配列の読み枠がずれると、蛍光リポーターのGFPとRFPの発現が切り替わるように作られている。そのため、GPF/RFPの蛍光強度を定量的に比較することで、RNAスプライシングの異常の有無やどのエクソンが関連しているかを迅速に評価できる(図1・左下、推薦論文)。

「RNAを抽出し、逆転写をしてRT-PCRで評価する通常の方法に比べ、このSPREADDは結果が出るまでの時間を短縮し、費用も安い。高いスループット性が特徴です。ライブイメージングできるため、機能解析などにも有効です。世界には、例えばルシフェラーゼの発光などを使う、ほかの系が開発されていますが、現段階でベストな方法だと考えています」(網代先生)。
一方、このシステムは、化合物がRNAスプライシング異常に作用するかどうかを調べるスクリーニング系としても使われる。化合物が効けば、RNAスプライシング異常が修正され、GPF/RFPの蛍光強度比が正常細胞のパターンに近づくからだ。このシステムによって効率的な候補化合物の抽出が可能になるのだ。
化合物合成や薬効評価も手掛けるワンストップな研究体制
実際に化合物を合成しているのもこの研究プロジェクトの強みの1つ。これまで萩原研究室では、主に選択的スプライシングのエクソン含有を促進するSRタンパク質を標的に、その活性を制御するリン酸化酵素群の阻害剤等を数多く作製してきた。そして、それらの化合物がスプライシング異常に起因する一部の疾患群に効果を示し得ることが病態モデルの解析等から分かってきた。また、化合物の標的分子は特定のRNAスプライシング変化に選択的に作用するため、正常なRNAスプライシングには影響を与えず、安全性が高いことも確かめている。
2015年には、家族性自律神経失調症のスプライシング変異に対して有効な新規化合物を萩原研究室が同定している。家族性自律神経失調症ではIKBKAP 遺伝子の20番目のエクソン下流のイントロン、6番目の塩基の変異があり、これによって20番目のエクソンがスキッピングされ遺伝子産物のIKAPの発現量低下と塩基コードを認識するtRNAの修飾異常が生じる。研究室で開発したRECTAS(Rectifier of Aberrant Splicing)をモデル細胞に処理すると、IKBKAP遺伝子の20番目のスキッピングが抑制されIKAPの機能が回復する(図2、参考資料1、参考資料2)。
「ある一定の、関連した骨格の化合物にはRNAスプライシングを制御する効果があるとわかってきており、遺伝病に共通する特定の遺伝子配列の機能やパスウェイが見つかるかもしれない」と網代先生は見込んでいる。
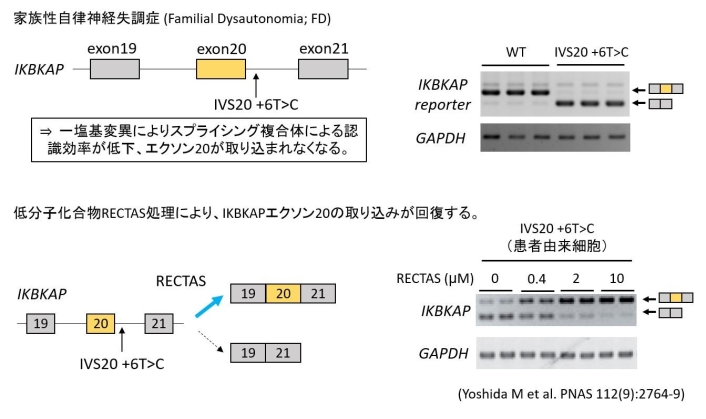
図2:家族性自律神経失調症(Familial Dysautonomia; FD)では、IKBKAP遺伝子の20番目のエクソン下流のイントロン6塩基目でT>Cの一塩基置換(IVS20 + 6T>C)によりエクソン20が認識されないことが疾患の原因となる。リポーターアッセイから同定された低分子化合物RECTASはこのIKBKAPエクソン20の調節因子に作用し、エクソン20の認識を回復させる。(図および文章編集:網代先生)
薬効評価に用いる材料はケースバイケースで、主に患者由来のiPS細胞、CRISPR/Cas9によるゲノム編集細胞、動物モデル等が用いられる。
細胞については国内外のバイオバンクや医療機関から患者由来細胞を入手したり、疾患の原因となる変異を導入した細胞を作製している。「ゲノム編集細胞での検証はiPS細胞の研究の傍証として必須です。iPS細胞における研究結果が、患者由来の他因子の影響を排除した、一般的なゲノム変異の結果として、疾患が起こっているということの証明が必要なのです」(網代先生)。

答える網代先生。
細胞系譜によってRNAスプライシングの制御因子や制御様式が異なるため、実際の組織により近い細胞で評価するのが望ましい。ただ、例えば、中枢神経系の疾患のモデル細胞は分化系が比較的確立しているのに対し、末梢神経系や感覚神経系はまだチャレンジングな分化系統が多いという。「ほかの疾患に関しても、病態モデルの細胞系譜が鍵になります。個々の疾患ごとにゲノム編集細胞やiPS細胞を最適化するためにはさまざまなスキルが必要です。専門性の高い研究機関や医療機関と積極的にコラボレーションして、病態モデルとその評価法を開発していきたいですね」と意欲を燃やす。
治験に向けて化合物を選定していく過程では、血中動態、吸収性、安全性が懸念されるような必<>須酵素への阻害活性の有無などを調べ、問題があれば、化合物を修飾して物性を改善していく。こうしたフィードバック・ループが機能するワンストップな研究体制が、成果還元のスピードを上げる要因だ。
米国国立がん研究所で培った
RNAスプライシング研究の専門性を創薬につなげる
化合物に新しくRNAスプライシング異常の回復効果が見つかった場合、その効果が出るメカニズムがどうなっているのかを必ず問われる。「そのメカニズムや解析の方法は化合物やターゲット配列によって異なるので、1つ1つ詳細に注意深く解析しないといけません」。網代先生が、そのような大変な作業でも精力的に取り組む理由は、何よりRNAスプライシング研究を治療に結び付けたいというモチベーションからだ。
網代先生が博士の学位を取得した2010年頃は、NGSの登場でスプライシングなどのRNAバイオロジーが急激に進展した時期だった。網代先生は研究員として米国国立衛生研究所(NIH)の機関である米国国立がん研究所(NCI)で6年間、主にRNAスプライシングを研究した。担当したのは、がん細胞やHPVのようながんの原因となるウイルスの感染によるRNAスプライシング異常。しかし、がんにおけるRNAスプライシング異常は数あるイベントの1つで、治療薬の標的とはなりにくい。そう感じながら帰国した網代先生の元に、ゲノム創薬基盤推進研究事業への参画機会が舞い込んだのだ。
生命現象の異常として疾患を理解し、医学や創薬、治療につなげる研究をしたいという初心に返る機会を得られたとも話す網代先生。医学、生物学、化学、インフォマティクスなどに携わる他のグループと共に、ケミカルバイオロジーという新しい手法で科学的な発見をしながら創薬に携わる日々に、「身につけた専門性を活かして新しいコンセプトの創薬研究に取り組めることにやりがいを感じています」と穏やかに笑った。
インタビュー動画
- コラム研究者紹介(youtube動画)
推薦論文
Rectifier of aberrant mRNA splicing recovers tRNA modification in familial dysautonomia
雑誌名 PNAS(Proceedings of the National Academy of Sciences of the United States of America)
号、発行年 March 3, 2015 112 (9) 2764-2769; published ahead of print February 9, 2015
研究者経歴
1981年、神奈川県生まれ。2004年に東北大学工学部卒業、2007年に東北大学大学院生命科学研究科・加齢医学研究所 修士課程修了、2010年に東京大学大学院新領域創成科学研究科・医科学研究所 博士課程修了。博士(生命科学)。米国立衛生研究所(NIH)研究員(平成22~27年度)を経て、2016年から現職。 専門は、疾患・ウイルス感染と関連するRNAスプライシング制御異常の研究。
掲載日 平成30年11月8日
最終更新日 令和2年3月30日


