アーカイブ インタビュー No.7「がんゲノム医療をけん引/リードする情熱と戦略」

国立がん研究センター 理事、研究所長、がんゲノム情報管理センター長
平成30年中の保険適用を目指し、重要な転換期を迎えるがんのゲノム医療。「国民皆保険(以下、皆保険)のシステムを利用することでゲノム医療は国力になる」と、EML4-ALKなどの原因遺伝子を発見し、産学官の連携でがん治療の新時代を築こうと尽力されている間野先生は話す。がんゲノム医療が切り開く日本の未来について、お話を伺いました。
がんは「遺伝子で分類する」時代へ
― この10年でゲノム研究をめぐる環境はどのように変化していますか。
1つは分子標的薬の進歩、分子標的治療*1)のパラダイムシフトです。今では抗がん剤の使用前にコンパニオン診断薬*2)で検査し、「治療標的陽性の人に限って治療をする」ということが常識になりつつありますが、かつては、肺がんの患者に、まずゲフィチニブを投与してみて、効いた患者の遺伝子を調べた結果、EGFR(上皮成長因子受容体)*3)に活性型変異があった、というように、今とは逆向きの方向で治療方法が議論されていました。
現在、EGFRやALK(未分化リンパ腫キナーゼ)*4)だけでなく、分子標的薬の対象となるような遺伝子変異が次々と明らかになっています。
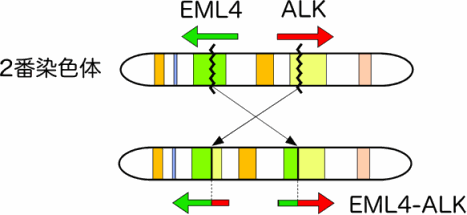
併せて、ゲノム医療の登場は、もう1つの大きな変化です。例えば、EML4-ALKという融合遺伝子は肺がんの原因になりますが、ALKはヌクレオホスミン(NPM)*5)と融合すると悪性リンパ腫を、ビンキュリン*6)と融合すると小児の腎臓がんを起こすことが知られています。
つい10年前までは、がんというものは、どこが原発か、がんの顔はどんな顔をしているか ──例えば腺がんなのか、扁平上皮がんなのか、大細胞がんなのかといった病理型で分類されていました。当然、治療薬の選択もそれに従い、基本的には発生部位と病理型で決まっていました。
ところが、遺伝子の側からがんを眺めると、どこが原発かを基準に臓器別に考えるのはあまり論理的ではない。ALKのようにキメラ遺伝子の形成が複数のがんの原因になりうるものに対しては、優れたALK阻害剤があれば、その薬・1つで治療できるわけです。つまり、臓器を超えた、がん遺伝子の遺伝子プロファイルによってがんを分類する時代がやってきたということです。それこそが、がんのゲノム医療そのものです。いよいよ我々が取り組んできたがん研究の成果が、がん医療のあり方を変えてきたと感じています。
無我夢中で開拓した 新たながん治療への道筋
― 間野先生が新たながんの原因遺伝子を突きとめてこられたことは、分子標的治療の可能性を大きく切り開きました。最初のEML4-ALKの発見に至った経緯をお聞かせください。
がん細胞では多くのゲノムの変化が起こるため、真にがん細胞の生存に関わる変異を見極める必要があります。そこで、がんの原因遺伝子を同定する新たな手法(レトロウイルスを用いたがん遺伝子スクリーニング法)を開発し、2007年に肺がんの新規原因遺伝子として、EML4-ALKの発見に至りました(図1、2007年7月12日 科学技術振興機構(JST)|肺がんの原因遺伝子を発見)。
もともと私は血液内科医で、慢性骨髄性白血病に対するイマチニブの有効性をよく知っていました。白血病細胞の増殖原因となるBCR-ABLという融合型の酵素に対し、劇的に効くのです。肺がんでも同様にチロシンキナーゼが染色体転座によって融合していたので「肺がんにもイマチニブのような薬がもたらされるかもしれない」と強く思いました。
― その成果を論文報告するに留まらず、韓国で行われたALK阻害剤(クリゾニチブ)の臨床試験では、日本から患者を送る試みもされていましたね。大きなチャレンジだったのではないでしょうか。
もともと某製薬企業が、c-Metを標的とする薬剤としてクリゾニチブの開発を進めていました。この薬剤はALK活性も抑制したことから、 EML4-ALKの発見を受けて、2008年にはEML4-ALK陽性肺がんを対象として臨床試験が始まっていたのですが、このころ偶然、私の講演を聴いた医師から「同じような患者を診ているのでEML4-ALKがあるか調べて欲しい」という申し出があったのです。
調べてみるとやはり陽性だったため、すぐに製薬企業に連絡して、その患者を韓国で行っていた臨床試験に入れてもらうことにしました。そして見事に効いたのです。その製薬企業も、治験実施先のソウル大学の病院もよく引き受けてくれたと思います。
最終的には約800人の患者をスクリーニングし、40~50人が陽性でした。韓国での治験についてお伝えしたところ、比較的若い方を中心に20~30人が参加され、皆さん快方に向かいました。
― なぜ、それほど多くの患者にリーチできたのでしょうか。そして、リスクについてはどのように対策されたのでしょうか。
せっかく効く薬があるのに、日本の患者がアクセスできないのは不公平です。何とかして日本の患者を救いたいという思いが募りました。そこで、日本の主だった肺がんの臨床施設・約100カ所とネットワークをつくり、2009年に「ALK肺がん研究会」を結成しました。全国から送られてくるサンプルを無償で調べ、EML4-ALKがないか診断する活動をボランティアとして始めました。
当時はとにかく夢中でしたが、今思えば、よくあんな危険なことをやったなとも思います。診断ミスがあるかもしれない、ということは常に心配としてありました。誤診で韓国に渡り、治療効果を得られないまま命を落とすことになったらと...。しかし我々は検査会社ではないため、検査値としての信頼性担保や、再現性の保証まではできません。そこで、リスクを最小限にするために、ロボットを整備するなどして、できるだけヒューマンエラーが入らない仕組みをつくりました。
ほどなくして日本でも臨床試験が始まり、並行してEML4-ALKを診断する商業的なサービスも始まったので、研究会もその使命を果たしたと思います。
人的ネットワークと研究者としてのキャリア

― EML4-ALKの発見が2007年、米国でのクリゾニチブの承認が2011年(日本では2012年)、その間わずか4年です。研究成果をいち早く臨床へつなげることができた理由はどこにあったのでしょうか。
クリゾチニブが史上最速のスピードで実用化に至ったのは、EML4-ALK陽性の肺がん患者に限って臨床試験を行ったことと、米国FDAが通常必要とする第3相臨床試験を不要として承認したことにあります。またNGS(Next Generation Sequencer:次世代シークエンサー)とそれを使いこなす解析法です。がんのゲノム解析が大きく進展したことで、他の治療標的も次々と明らかになりました。私は、2007年当時、まだ日本で普及し始めたばかりのNGSを導入した研究者の1人でしたが、国際的な競争に踏み込む上では、JSTの戦略的創造研究推進事業・研究加速課題として「新規がん遺伝子同定プロジェクト」が選定され、大型の研究予算を獲得できたことは研究基盤整備を進め、がんゲノム研究の追い風となりました。
当時は圧倒的な研究設備量とこれを用いる人材数の差として、日本はアメリカに遅れを取っていましたから。
そして、私自身が医師・研究者としてキャリアを積んでいたことも挙げられます。もし、20代でEML4-ALKを見つけていても、すぐにマウスで発がん性を検証し、投薬試験をして、製薬会社とコンタクトを取り、患者が治験に参加できるようにネットワークをつくり…というところまで、絶対できなかったと思うのです。やはり、それまでの長い研究者人生で得られたキャリアと人脈があったからこそ、あれほど短期間で患者の元に薬が届けられたのだと思います。
― 基礎研究のあり方、産学官の橋渡し(トランスレーショナルリサーチ、TR)の現状については、どのようにお考えですか。
これは、自分が実際に患者を救うことのできる研究をしたからこその実感ですが、やはり基礎研究はとても大切です。応用研究ばかりを狙うような国では、大きな発見はなかなか出ないでしょうし、がん研究に限らず、裾野を広くさまざまな基礎研究ができる国であって欲しいと思います。近視眼的な応用研究ばかりが進むようではいけません。
がんの領域では私が次世代がん医療創生研究事業、臨床ゲノム情報統合データベース整備事業の両プログラムオフィサー(PO)として、優れた基礎研究者を守っていくことも大事な役割だと思っています。今後はより一層、ゲノム研究とゲノム医療がシームレスに連動できるように注力していきたいですね。
また、がんのゲノム医療では、アカデミアとインダストリーの距離が近くなってきましたが、例えば、糖尿病や高血圧などの生活習慣病とゲノム医療、精神疾患とゲノム医療など、他の疾患に関しては、まだまだ薬に到達するまでの距離が長いです。そこはやはり国がきちんとTR研究をサポートしていく必要があると思います。
― 人的なネットワークをうまく構築する秘訣は何だと思いますか。
難しい質問ですね。本当のことを言えば、それは中心となる人物のパッションが一番大切だと思いますが、若手のうちから人的交流の機会を得ることも大切です。
文部省時代の「がん特別研究」という事業では、年に1~2回、若手から教授まで日本中から何百人という規模で集まる機会がありました。2日ほどかけて泊まり込みで、全員が発表するため、学会のように受け身ではいられないのです。緊張感もあり、密な時間を共有することで、いろいろなフィールドの人がお互いをよく知ることができました。私もここで多くの知り合いができました。最近はこうした場が減っているので、積極的に機会をつくりたいと思っています。
― 2016年から始まった次世代がん医療創生研究事業「P-CREATE」では若手育成枠があり、ワークショップなどを通じた育成にも取り組まれていますね。
再生医療などの新領域に注目が集まっていることもあり、以前よりがん研究に参入する人は減ってきています。しかし、今ほどがん研究が面白い時代はありません。自分の発見が、研究者人生を終える前に日の目を見ることも夢ではありません。これほどダイナミックでやりがいのある研究フィールドはかつてなかったのではないかと思います。がんが生じるメカニズムについては分かっていないことも多く、基礎研究でもオリジナリティーが高ければ素晴らしい成果になると思います。ぜひ、若い人には基礎でも応用でも、自分が本当に面白いと思えるテーマをがん研究の中で見つけてもらいたいですね。
保険診療でゲノム医療は日本の強みになる

― がんのゲノム医療について、今後の見通し・展望をお聞かせください。
2019年中に保険診療としてのがんのゲノム医療が始まろうとしています。日本でゲノム医療が国民皆保険の下で始まることはエポックメイキングな出来事です。がん医療においても最大の変革になると思います。どの臓器のどんな細胞のがんであっても、保険承認薬や治験薬に対して遺伝子変異を全て調べた上で、一人一人の患者に最適な薬を選べるようになるのです。
厚生労働省では2017年からがんゲノム医療推進コンソーシアム懇談会で議論が重ねられ、新たな医療体制について、ゲノム情報の集約・保管や利活用についての方向性が示されました。2018年には、がんゲノム医療中核拠点病院として全国11カ所の病院と、各病院と連携するゲノム医療連携病院が135カ所が選ばれました。同年4月からは「個別化医療に向けたマルチプレックス遺伝子パネル検査研究」として、先進医療Bで抗がん剤選択のための遺伝子検査が実施されるなど、保険適用を目指す動きが加速しています。
すでに諸外国では企業主導でゲノム医療が行われています。例えば、米国では、患者のサンプルを送ると、315種類の遺伝子の変異や融合を一度に調べ、その結果を病院にレポートするというサービスがあります。しかし何が問題かというと、臨床情報の集約が困難なのです。せっかくゲノム情報があるなら、臨床情報と照らし合せて解析し、さらなる開発研究につなげたい──例えば、ある遺伝子変異に対して投薬して、その薬が効いた人と、予想に反して効かなかった人がいた場合、両群に分けて別の変異の影響を調べるといったことが考えられます。
日本は皆保険なので、中核拠点病院・連携病院のようなネットワークをつくれば、各地から重要な臨床情報をデータセンターに集約することが可能です。日本は国という単位でゲノム情報と臨床情報を一緒に解析することができる、世界で唯一の国になると思うのです。皆保険というシステムを利用することでゲノム医療は、非常に大きな国力になると思います。
― それを実現していくためには、ゲノム情報の保管や提供に関するルールづくりが重要ですね。また、利活用の方向性としては、どのようなことが想定されているのでしょうか。
AMEDによる臨床ゲノム情報統合データベース整備事業では、2016年からさまざまな疾患のゲノム情報と臨床情報を集約するデータベースを構築してきました。そして、2018年6月からは国立がん研究センターの中に「がんゲノム情報管理センター(Center for Cancer Genomics and Advanced Therapeutics ;C-CAT)」が設置され、私はセンター長を務めています。C-CATでは、全国から集約した保険医療におけるがん患者の臨床情報とゲノム情報を安全に保管し、利活用するためのプラットフォームをつくっています。新たな医療の創出のために、適切な形で多くの人が利活用できる仕組みを構築しています。
それは単に研究利用に限らず、患者に直接還元できる形を目指しています。例えば、EML4-ALKは肺がんで見つかれば保険適用になりますが、まれに大腸がん等で見つかることがあります。そうなると適用外になるので、今の段階では自由診療で患者の自費負担になってしまいます。それを来年以降、国内の病院を結ぶネットワークとデータベースをつくることで、肺がん以外のALK陽性の患者がある程度いるならば、施設限定で承認するという形で、保険の診療枠内で認めたら良いのではないか、ということが真剣に議論されています。
こうしたことが可能になれば、登録した患者は将来のためにデータ提供するだけでなく、自分自身が直接的なメリットを受けられるようになります。日本は米国などに比べると、承認されて使える薬が少ないので、患者の治療選択肢をいかに最大化するかということに、このデータベースとネットワークを使っていきたいと考えています。
― 今後、取り組むべき課題としては何が挙げられますか。
日本では毎年約100万人が新たにがんと診断され、38万人ががんで亡くなっています。これだけの人に対応するインフラを整備する上では、慎重さも求められます。
ゲノム医療が進めば、家族性腫瘍の患者も見つかってくるでしょう。患者だけでなく、ご家族も検査した方が良い場合もあるかもしれません。遺伝カウンセリングの体制が十分でなければ、大きなトラブルが生じる恐れがあります。遺伝カウンセラーが不足している日本では、遺伝子検査の結果を正しく伝えられる人材の育成・体制整備は喫緊の課題です。
また、リテラシーという点では医療従事者に限らず、中学生ぐらいから誰でも最低限の知識を身に着けておいた方が良いと思うのです。例えば、がんは体細胞ゲノムの変異が原因なので基本的には遺伝しないということや、一部がんになるリスクを高めるような遺伝子異常が精子や卵子のゲノムを介して遺伝することもある、といったことを。そうでなければ「あの家のお父さんは胃がんだから、息子と結婚するのはやめた方がいい」といった風評被害が起きかねません。
ゲノム医療が皆保険で行われるようになる以上、義務教育で病気と遺伝の関係について、基本的な知識を教えることも必要になってくると思います。ゲノム医療が真に定着するためにも、国民全体でゲノムリテラシーを高めていくことが大切です。
(取材日:2018年11月15日、聞き手:一般社団法人知識流動システム研究所 監事 隅蔵 康一)
用語解説
- *1)分子標的療法
- がん細胞のみを狙い撃ち、副作用を少なくしようとする治療法。がん細胞と正常細胞の違いを遺伝子レベル、分子レベルで解明し、がんの増殖や転移に必要な分子だけを抑えることで治療する。
- *2)コンパニオン診断薬
- 特定の医薬品の有効性や安全性を一層高めるために、その使用対象患者に該当するかどうかなどをあらかじめ検査する目的で使用される診断薬。
- *3)EGFR(Epidermal Growth Factor Receptor、上皮成長因子受容体):
- 非小細胞肺がんの細胞表面に発現し、発がん原因となるたんぱく質。遺伝子変異の中にはEGFRのスイッチを常時ONにして、がん細胞の増殖を促すものもある。
- *4)ALK(Anaplastic Lymphoma Kinase、未分化リンパ腫キナーゼ):
- 他の遺伝子との融合(キメラ化)により腫瘍形成に関与する受容体チロシンキナーゼ。その1つであるEML4-ALKは遺伝子転座による肺がん原因遺伝子として知られる。
- *5)NPM
- 核小体に存在するリン酸化たんぱく質。細胞増殖や細胞分裂の制御などに携わる。
- *6)ビンキュリン
- 細胞接着で重要な役割を持つたんぱく質。
インタビュー映像
推薦論文
- タイトル
- がんゲノム医療推進コンソーシアム懇談会報告書
- 著者名
- 厚生労働省
- 号、発行年
- 2017年
- 推薦趣旨
- 論文ではありません、が厚労省において策定され、これを元に平成31年度に日本でがんゲノム医療が実施される予定です。
研究者経歴
1959年、岡山県生まれ。1984年3月に東京大学医学部卒業。1992年に東京大学より医学博士号取得。 1984年に東京大学医学部附属病院 内科研修医、1986年に東京大学医学部第三内科 医員、1989年5月から米国St. Jude小児研究病院生化学部門 客員研究員、1991年に東京大学医学部第三内科 文部教官助手、1993年8月から自治医科大学医学部 講師、以降、同大学にて助教授、教授を務めた。 2013年4月に東京大学大学院医学系研究科 教授(2018年3月31日まで)、2016年4月に国立がん研究センター 研究所長、2018年に国立がん研究センター がんゲノム情報管理センター長に就任、現在に至る。 近年は、2012年度に紫綬褒章、慶應義塾医学振興基金 慶應医学賞、細胞科学研究財団 塩野賞、日本癌学会 JCA-CHAAO賞、2015年度にベーリンガーインゲルハイム ベルツ賞(1等賞)を受賞。
掲載日 平成31年2月27日
最終更新日 令和2年3月30日


