アーカイブ 神経筋疾患診断の難しさを、最新の遺伝子解析技術とデータ蓄積で乗り越える

三井 純 特任准教授/石浦 浩之 助教
東京大学医学部附属病院 神経内科
臨床診断までは行えるが、その原因がわからない、原因がわからないので治療法の開発が進まない。東京大学医学部附属病院 神経内科の三井 純先生と石浦 浩之先生は、このような事例を症例数の少ない希少・難病分野、特に神経筋疾患診療の現場で数々目にしてきた。
しかし、日本全国で得られた結果をデータベースに蓄積することによって、原因遺伝子が明らかになり、病気の理解や治療法の開発に近づけていくことができるかもしれない。平成28~30年度 臨床ゲノム情報統合データベース整備事業「希少・難病分野の臨床ゲノム情報統合データベース整備」(研究開発担当者:東京大学医学部附属病院 辻 省次)では、NGS(Next Generation Sequencer:次世代シークエンサー)を駆使したゲノム解析を中心に、希少・難病のクリニカルシーケンスによる診断確定を進め、それらを臨床ゲノム情報統合データベースとして整備している。
学童期に発症し、原因不明のまま20代で東京大学医学部附属病院を受診、当時は症状から学童期発症の脊髄小脳変性症と臨床診断されながら、10年以上もの間、原因遺伝子の特定ができなかった患者・Aさんが、2014年に初めて、乳児期発症の重篤な疾患として知られていた「D-二頭酵素欠損症」*1)の軽症型だと明らかになった事例を三井先生は振り返り語った。
臨床だからこそ成し遂げる
日本人由来の神経系遺伝子疾患のシークエンスデータベース

答える三井先生。
「これまでも脊髄小脳変性症を引き起こす既知の遺伝子についての遺伝子解析を行っていましたし、2012年には網羅的なエクソーム解析を行っていました。でも、原因となる遺伝子変異は見つからなかったのです。見つからないはずです。当時、脊髄小脳変性症の症状を引き起こすことが知られていなかった遺伝子に変異があったのですから」(三井先生)。2014年頃、学童期発症の脊髄小脳変性症と診断された患者にD-二頭酵素欠損症で見られる遺伝子変異があったという報告がいくつかの学術論文で示されたことを受けて、三井先生は過去、Aさんが行った遺伝子診断の解析データを見直し、原因遺伝子を突き止めたという(参考資料1)。「目の前の患者の症状と関連することが知られていない遺伝子の場合、遺伝子変異があってもそれを原因と判断できないため、エクソーム解析だけを行っても(正しい)診断ができません。同じような症状を持っている複数の患者に同じ遺伝子変異があることを見つけて初めて"これが原因なのだ"と分かります。そういった情報を蓄積して、患者の同意を得た上で適切に共有することで、新しい発見や診断率の向上が期待できるのだと思います」(三井先生)。
脳・脊髄・末梢神経・筋肉の病気を診療する東京大学医学部附属病院 神経内科では、研究として遺伝性神経疾患の遺伝子診断を行っている。現在は遺伝性神経疾患であるハンチントン病、脊髄小脳変性症、球脊髄性筋萎縮症といったトリプレットリピート病*2)の遺伝子診断の他、パーキンソン病関連疾患、痙性対麻痺、副腎白質ジストロフィー、プリオン病、筋萎縮性側索硬化症、アルツハイマー病、その他の認知症性疾患などに関連する遺伝子診断についても対応しているという。
三井先生・石浦先生は、日々の外来診療を行いながら研究も進め、年間200~300件の検体を受け入れて遺伝子診断、データストレージへ追加しているという。2018年8月段階で東京大学医学部附属病院からの登録は全体で665例。主な疾患は、脊髄小脳変性症287例、遺伝性てんかん94例、球脊髄性筋萎縮症79例、ハンチントン病74例、遺伝性筋萎縮性側索硬化症70例などだ。
大まかな役割分担として、東京大学医学部附属病院内外から集まる検体を遺伝子解析する際の品質管理や作業手順のマニュアル化などを三井先生が、外部から送られてくる検体の受け入れ対応や同意書の整備、解析データ・臨床情報のデータストレージ化を石浦先生が担ってきた。
遺伝性神経疾患におけるデータベースの有用性と課題
十数年前、シーケンシング技術の大きな革新、NGSの実用化によって、遺伝子解析が進展、普及した。これにより、その当時から数年間で徐々にエラー率が下がり、読めるゲノムの長さ(データ量)も増えてきた。
技術的な面で広がった解析の可能性に加えて、ここ5年くらいは"解析データの蓄積"が診断に役立つレベルに発展してきたと石浦先生は振り返る。
「コントロールのデータがすごく増えていることが、大きく違うところだと思います。5・6年前ですと、東京大学医学部附属病院のデータベースは100人分ぐらいしかなく1,000人に1・2人しかいない変異が全く分らなかったのです。それが今では、東京大学医学部附属病院で遺伝子解析された方は1万人を超えています。しかも、ずっと昔から同じ方法で解析し、データ蓄積しているので、『全然別の患者で同じ変異があったから、これは病気と関係ない遺伝子変異かな』といった比較検討がしやすくなりました。また、学内の他の研究室、東北メディカル・メガバンク(ToMMo)、海外の米国・ゲノム変異情報データベース「ClinVar(クリンバー)」などのデータを参照すると、病気と関係ないものがすぐにわかる。残ったものが病気と関係あるでしょう、とパワフルに言えるようになったと思います」(石浦先生)。
これに加えてAMEDが臨床ゲノム情報統合データベース整備事業(図1)で構築を図ろうとしている「臨床ゲノム統合データベース(MGeND)」における希少・難病の非制限公開データベースには、日本人由来の原因変異が特定された遺伝子解析データで、かつ、診断がついたものが個人情報を除いた臨床情報が蓄積されることから、日本の臨床現場での診断に寄与することが期待される。
また、病気の診断がついていないケースを保有する制限公開・制限共有データストレージでは、網羅的なエクソームや全ゲノムのデータが蓄積され、共同研究者内または審査を受けた研究者に制限公開される。
「患者数の少ない希少疾患では特に、病原性変異データの蓄積が少なく、遺伝子解析データだけで診断を行うことが難しいことがあります」(三井先生)。
時には再度臨床評価や追加の検査を行う、患者の血液や細胞を使った機能解析をするなどして、試行錯誤することもある。そうしたことから、やはり国の支援を受けながら、遺伝子解析し解析結果などをデータベース化できる拠点を設けて症例を集める方がいいと感じていると語った。
そのためには、遺伝子解析がわかる人材を各大学や病院で育成すること、倫理審査や同意取得のあり方を改善する必要があると石浦先生は感じているという。
「『東京大学医学部附属病院に検体を出したい』と主治医も患者も思っているのに、所属機関の倫理委員会からなかなか承認が下りない、何カ月もかかる、膨大な資料を書かされるといったことが現実的に起きています。研究として検体を解析するためには仕方のないことではありますが、病院ごとに承認を得る必要があるといった制度により、全国からの検査依頼に応えたい中で、現場の負担は大きくなっています」(石浦先生)。
もちろん、無責任に検体を使っていいはずはない。しかし、患者を守るための規制によって手続の負担が増え、解析に進められないことは、憂慮すべき現状だ。
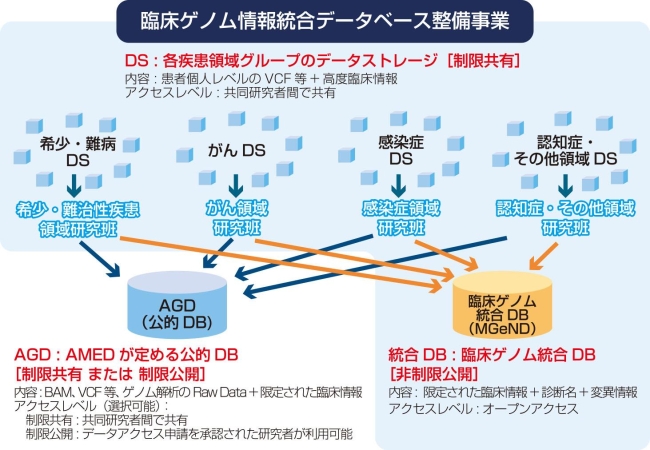
図1:「臨床ゲノム統合データベース整備事業」 概要図
シークエンスデータベースは孤発性疾患の遺伝因子探索に変化をもたらす
三井先生は「孤発性疾患に関しては、将来何十万・何百万人分のデータベースとなれば効いてくる。ゲノムワイド関連解析(Genome-Wide Association Study:GWAS)では見つけにくい、疾患に強く影響する低頻度の変異は、今後、大規模なデータの蓄積によって徐々に解明されると期待しています」と語る。
複数の遺伝因子・環境因子が関与する「孤発性疾患」は、多くの神経変性疾患において、大部分の患者が該当するという。これまでGWASによって孤発性疾患の数多くの疾患感受性遺伝子が同定されたが、同定された遺伝因子の影響度は一般的に低く、多くの孤発性神経変性疾患で観察される家族内集積性のメカニズムが明らかになっていないという。
三井先生は、これまで未解明だった、GWASでは見つけにくい"低頻度で影響度の大きい遺伝因子探索"に注目している。その成果として、2013年以降、家系例を手掛かりとして孤発性患者において強い影響度を持つ遺伝因子を、多系統萎縮症(MSA、遺伝因子はCOQ2遺伝子、参考資料2)やパーキンソン病(遺伝因子はGBA遺伝子(図2)、参考資料3)でも明らかにしている。こういった成果から「家族内集積を示す家系例を手掛かりとして、GWASでは見つけにくい遺伝因子を探索するアプローチは効率的だと感じています。今後、大規模なデータの蓄積が進めば、より多くの遺伝因子が見つけられるかもしれません」と語った。
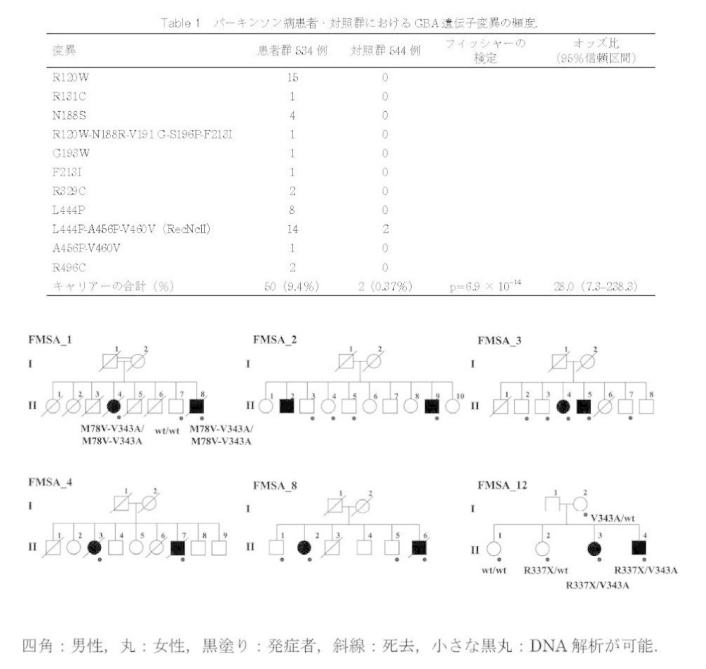 図2:パーキンソン病疾患・対照群におけるGBA遺伝子変異の頻度と、多発家系2家系におけるCOQ2遺伝子変異の確認
図2:パーキンソン病疾患・対照群におけるGBA遺伝子変異の頻度と、多発家系2家系におけるCOQ2遺伝子変異の確認6家系を対象に常染色体劣性遺伝性で単一の遺伝子座を仮定してパラメトリック連鎖解析を行ったところ、仮定に合致する遺伝子座は見つからなかった。一方、遺伝子座異質性を許容したパラメトリック連鎖解析では、仮定に矛盾しない複数の遺伝子座位が検出され、遺伝子座異質性が存在することが示唆された。この家系の発症者に対して全ゲノム解析を施行し、健常者に見られない変異に絞りこんだところ、COQ2遺伝子のホモ接合性にM128V-V393A変異が唯一同定された.もう 1家系でも COQ2遺伝子に R387X と V393A の複合ヘテロ接合性変異を認め、COQ2遺伝子が家族性 MSA の原因遺伝子の1つであることがわかった。(図版提供:三井先生)
NGSを駆使して、てんかんの新しい発症機構を突き止める
疾患発症に直接関与する「繰り返し配列の異常伸長」

答える石浦先生。
石浦先生は2018年に、てんかんの1つのタイプである「良性成人型家族性ミオクローヌスてんかん」の新たな発症機構解明を発表した(2018年3月8日東京大学によるプレスリリース参照、参考資料4)。この疾患は、国が定める指定難病「進行性ミオクローヌスてんかん」に含まれるもので、今回NGSによる51家系100名のゲノム解析データから、49家系において、SAMD12という遺伝子のイントロン*3)中に、元のゲノム上には存在しない、異常に伸長した新規のTTTCAという5塩基が繰り返し挿入されていることを発見(図3)、発症原因となっていることを突き止めたという。また、2家系では、TNRC6A、RAPGEF2という別の遺伝子に同様の繰り返し配列が存在することも併せて見出した。このような配列の変化は、これまで、てんかんでは全く知られていなかった現象だ。繰り返し配列の繰り返し数は、おおよそ440~3,680回の範囲。この長大な繰り返し配列の読み込み、ロングリード解析には、平成28~30年度ゲノム医療実現推進プラットフォーム事業「先端ゲノム研究開発(GRIFIN)」採択課題タイプA(大規模ゲノム解析を伴う研究)「ヒトゲノムDe Novo情報解析テクノロジーの創出」(研究開発代表者:東京大学 大学院新領域創成科学研究科 森下 真一)の研究成果が活かされているという。3つの遺伝子に同じ繰り返し配列の異常伸長が認められたことは、発症原因として繰り返し配列の異常伸長そのものが重要であり、存在する遺伝子の種類に依存しないことを示している。
「クリニカルシーケンスの診断率は30-40%といったところです。これまで分かっていること以上に、わからないことが数多く存在します。それらを解き明かしていくことで、病気の成り立ちを突き詰めれば人体についての理解が深まっていくものと思っています」(石浦先生)。
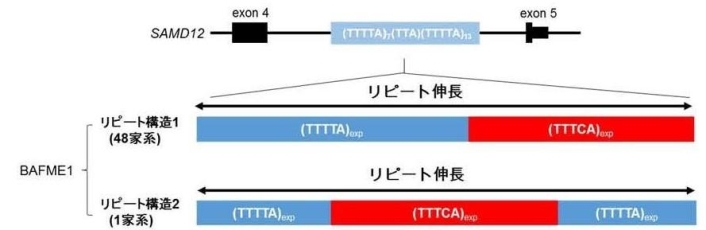
図3:SAMD12遺伝子に認められた 2 種類のリピート伸長変異
SAMD12遺伝子のイントロンにリピート伸長変異が同定された。元々存在する短い TTTTAリピートが伸長するのみならず(青)、新しい TTTCA リピート伸長配列(赤)が挿入されていることが判明した。ロングリードシーケンスを行い、2 種類のリピート構造を確認した。exp は伸長していることを示す。(図版提供:石浦先生)
要因遺伝子変異の発見と臨床の見直しの両輪で、診断につなげる

接する日々が、研究への
熱意につながっている。
石浦先生は「病気の原因が不明というのは患者にとってつらいことです。すぐには治らないかもしれないけれども、こういう病状はよく起こるのですよ、ほかの方にも見られますよ、このような治療で病状がよくなるかもしれませんよ、という話ができるだけでもだいぶん違ってくるのです」と話す。「なぜか神経と筋肉の病気は、遺伝性のものが、ほかの分野より多いです。これまで当科で行ってきた研究も、実際にお会いした患者から得られた知見をベースに発展させてきたものがほとんどです。遺伝子が関係していると思われる患者に対して、その原因の大もとである遺伝子の解析をすることで、病態を理解し、研究を促進し、治療法につなげていくことができるような支援が今後も続くことを望みます」(石浦先生)。
遺伝子解析だけでは患者の病気を100%説明しきれない。シークエンスデータベースを参照しながら、追加の分析をし、患者の臨床を見直すことで分かってくるケースも多く、単純に検査し、解析結果だけをお返しすするだけでは済まないという。しかし、そういった探求と蓄積が、さらなるデータベース充実につながり、新しい発見や今後の「診断」に貢献するのだ。
用語解説
- *1)D-二頭酵素欠損症
- ペルオキシソームたんぱく質の局在や形成にかかわる遺伝子に変異が起こる、ペルオキシソーム病(形成異常)の1つ。ペルオキシソーム内で脂肪酸β酸化に関与するD-二頭酵素欠損症が欠損する疾患。乳児期発症の重症型では特徴的な顔つき、筋力が弱い、乳を飲まない、発達の遅れ、痙攣、肝腫大などを発症する。
参考サイト:難病情報センター
- *2)トリプレットリピート病
- トリプレット病とはゲノム内の遺伝子に存在する3塩基の繰り返し配列(トリプレット・リピート)が異常に伸長することによっておこる一群の遺伝性神経疾患。これらの疾患においては、リピート長が遺伝学的に不安定で、親から子孫への疾患遺伝子の伝播に伴ってリピート長が変動することが多い。少なくとも17種類の疾患が知られている。トリプレット病におけるリピート長の伸長は、遺伝子産物(たんぱく質・RNA)の機能喪失または機能獲得の機構を介して、病態を発症させると考えられる。
出典:日本神経科学学会 脳科学辞典 トリプレット病
*3)イントロン- たんぱく質を作る情報を持たない非コード領域。
インタビュー動画
- コラム研究者紹介(youtube動画)
推薦論文
研究者経歴
三井 純
1976年、石川県生まれ。2001年に東京大学医学部 卒業。2010年に東京大学大学院 医学系研究科 修了。博士(医学)。2010年から東京大学医学部附属病院 特任助教などを経て、現職。専門は、神経内科学。
石浦 浩之
1977年、東京都出身。2002年に東京大学医学部 卒業。2011年に東京大学大学院 医学系研究科 修了。博士(医学)。2010年に日本学術振興会 特別研究員を経て、現職。専門は、神経遺伝学。
掲載日 平成31年3月7日
最終更新日 令和2年3月30日


